|
|
(enero-junio 2025) Vol. 4 Núm. 1 ISSN (online): 2953-6596 |
Biodiversidad asociada a la zona intermareal rocosa y arenosa de la playa El Pelado, Ecuador.
Biodiversity
associated with the rocky and sandy intertidal zone of El Pelado
Beach, Ecuador
Quijije Genny1*: https://orcid.org/0009-0004-4697-0907
Kuonqui Ana1: https://orcid.org/0009-0003-5572-5260
Delgado Alexander1: https://orcid.org/0009-0000-1966-6599
Ochoa Jean1: https://orcid.org/0009-0002-5133-1945
Morales Felix1: https://orcid.org/0000-0002-1961-063X
1Facultad de Ciencias de la Vida, Escuela Superior Politécnica del Litoral, Ecuador.
*Autor correspondencia: gandreaqf@gmail.com
Recibido: 26/febrero/2025 Aprobado: 14/junio/2025 Publicado: 30/junio/2025
Es un
artículo de acceso abierto con licencia Creative Commons de Reconocimiento-No Comercial-Compartir Igual 4.0
Internacional, lo que permite copiar, distribuir, exhibir y representar la obra
y hacer obras derivadas para fines no comerciales y de revistas de OPEN JOURNAL SYSTEMS (OJS).
Resumen
Los ecosistemas costeros se caracterizan por la presencia de la zona intermareal, cuyos factores ambientales son dinámicos y dependen de los periodos de alta y baja marea. En la presente investigación se analizó la biodiversidad de las zonas intermareales rocosa y arenosa de la playa El Pelado, Ecuador. Se realizaron muestreos en tres transectos para cada tipo de sustrato, midiendo parámetros fisicoquímicos y registrando la abundancia de organismos. En el sustrato arenoso, se encontró una limitada diversidad de especies que incluyó dos isópodos, una estrella de mar, un bivalvo, un gasterópodo y un anélido. Además, se registró un promedio de temperatura de 26.9 °C en la línea de marea baja mientras que a los 30 m de distancia la temperatura promedio fue de 35.6 °C. En el sustrato rocoso se evidenció mayor biodiversidad, especialmente en las piscinas de marea, donde se registraron variaciones de temperatura entre 26.8° C y 31.2° C, y salinidad en un rango desde 32.0 hasta 33.2 PSU. Se identificaron diferentes zonas de distribución de organismos: zona intermareal baja dominada por algas de los géneros (Ulva, Ceramium), zona media con predominancia de Balanus, y zona alta con abundancia de percebes y mejillones. Las interacciones ecológicas fueron más evidentes en el sustrato rocoso, destacando la relación epibiótica entre mejillones y percebes. Los resultados demuestran que las diferencias en las características físicas de ambos sustratos determinan la composición y estructura de las comunidades bentónicas, siendo el sustrato rocoso el que presenta mayor diversidad.
Palabras clave: Biodiversidad marina, parámetros fisicoquímicos, piscinas de marea, plataforma rocosa, sustrato arenoso, zona intermareal.
Abstract
Coastal ecosystems are characterized
by the presence of the intertidal zone, whose environmental factors are dynamic
and depend on high and low tide periods. In this research, we analyzed the
biodiversity associated with the rocky and sandy intertidal zone of El Pelado beach, Ecuador. Sampling was conducted in three
transects for each type of substrate, measuring physicochemical parameters and
recording organism abundance. Limited species diversity was found in the sandy
substrate, including two isopods, a starfish, a bivalve, a gastropod and an
annelid. Additionally, a temperature range of 26.1 °C to 38.8 °C was recorded
according to the distance from the sea. The rocky substrate showed greater
biodiversity, especially in tide pools, where temperature variations from 26.8
°C to 31.2 °C and salinity ranging from 32.0 to 33.2 PSU were recorded.
Different organism distribution zones were identified: the lower intertidal
zone dominated by algae genus (Ulva, Ceramium),
the middle zone with a predominance of Balanus, and the upper zone with
abundant goose barnacles and mussels. Ecological interactions were more evident
in the rocky substrate, highlighting the epibiotic relationship between mussels
and barnacles. The results demonstrate that differences in the physical
characteristics of both substrates determine the composition and structure of
benthic communities, with the rocky substrate showing greater diversity-
Keywords: Intertidal zone, marine biodiversity, physicochemical parameters, rocky
platform, sandy substrate, tide pools.
Introducción
La biodiversidad es un indicador clave de la salud de los ecosistemas costeros que puede analizarse a través de la composición y abundancia de la macrofauna (Afghan et al., 2020). Estos ecosistemas marinos ofrecen servicios ecológicos como la regulación del clima, la protección costera y la provisión de alimentos para comunidades locales (Barbier et al., 2011). Dentro de estos, destaca la zona intermareal que posee una alta diversidad de organismos marinos bentónicos expuestos a diversos tipos de sustrato y factores ambientales dinámicos que dependen de los periodos de marea alta y baja (Sibaja & Troncoso, 2024; Nascimento & Zacagnini, 2023).
Debido a las condiciones ambientales adversas, estos organismos se han adaptado para resistir el estrés térmico, la desecación, la hipoxia, el estrés salino y el movimiento de las olas (Leeuwis & Gamperl, 2022). Además, Hawkins et al. (2020) indica que las interacciones biológicas a nivel de comunidad son relevantes para comprender las dinámicas de las especies dado que en los sustratos arenosos y rocosos se pueden encontrar relaciones de competencia, depredación y pastoreo.
La zona intermareal arenosa ocupa un tercio de las costas alrededor del mundo en comparación a otros sustratos, alberga comunidades biológicamente diversas y aporta con 56 servicios ecosistémicos (Harris & Defeo, 2022; Escrivá et al., 2020). Factores físicos como los periodos de oleaje y la pendiente de la playa determinan la diversidad que pueden tener estos ambientes. Por ejemplo, los organismos bentónicos dependen de la cantidad de oxígeno que es llevado por las corrientes y el oleaje para realizar la respiración (Vera, 2017).
De acuerdo con Johnson (2024), la zona intermareal rocosa comprende un tercio de las costas a nivel mundial y se caracteriza por su formación en líneas costeras que poseen poca acumulación de sedimentos. La mayoría de los organismos asociados a este entorno se mantienen sésiles e incrustados a la roca, debido a esto se ven afectados por la radiación y el oleaje. Estos seres vivos se han adaptado a través de regulaciones fisiológicas o mediante cuerpos calcáreos en los cuales se esconden para reducir la pérdida de agua (Leeuwis & Gamperl, 2022). Los organismos más abundantes en estos ecosistemas son moluscos, artrópodos y algas (Barboza & Defeo, 2015; Ferrer, 2023).
En las plataformas rocosas se forman depresiones que mantienen el agua de mar durante la marea baja, conocidas como piscinas de marea. En estas viven algas, líquenes, esponjas, anemonas, anélidos marinos, crustáceos, moluscos, equinodermos y algunos peces (Satyan & Thiruchitrambalam, 2018). Adicionalmente, las piscinas de marea se caracterizan por fluctuaciones de temperatura y salinidad debido a la reducida cantidad de agua almacenada. Los organismos asociados a estas formaciones han desarrollado mecanismos que potencian su supervivencia como lo son mayor tolerancia a altas temperaturas o conchas de color claro para reflejar eficientemente la luz solar (Baird, 2002).
En Ecuador, el estudio realizado por Cárdenas et al. (2020), sobre la diversidad en la costa ecuatoriana reveló la presencia de 479 especies de macroinvertebrados bentónicos y 133 de algas. En esta investigación se evidenció una mayor diversidad bentónica en áreas protegidas y en sedimento rocoso de la zona intermareal, dominada por organismos sésiles entre los que destacaron moluscos, cnidarios y artrópodos. Los autores resaltan la importancia de estos estudios en el litoral para comparar con otras comunidades bentónicas y monitorear cambios en la biodiversidad.
El presente trabajo tiene como objetivo caracterizar la composición y la estructura de la comunidad bentónica en la zona intermareal rocosa y arenosa de la playa El Pelado, mediante muestreos con cuadrículas para el desarrollo de una línea base de biodiversidad que respalde la futura gestión costera de la zona. Además, se comparan los parámetros fisicoquímicos y biológicos para identificar los parámetros condicionantes y las interacciones de la biota presente en estos ambientes. Se realiza este estudio con la finalidad de aportar información de referencia para detectar variaciones derivadas de actividades antropogénicas y del cambio climático, sirviendo como punto de partida para programas de monitoreo y conservación en la provincia.
Materiales y métodos
Área de estudio
El estudio fue realizado en la playa El Pelado, en la provincia del Guayas, en el cantón General Villamil en enero de 2020. La playa se encuentra a una latitud y longitud de 2°34'20.96 " S y 80°29'14.88" O. Su clima tropical varía entre los 23 ºC a 25 ºC, tiene precipitaciones hasta 500 mm/año y posee una extensión costera de 6 km conteniendo playas con fondo arenoso y una plataforma rocosa (Herrera et al., 2018).
Muestreo en sustrato arenoso
Se realizaron tres transectos en la playa arenosa. En cada transecto se señalaron 6 sitios utilizando estacas con 10 m de separación entre ellas, teniendo como primer punto a 0 m del mar, el siguiente a 10 m y el último a 50 m. En cada sitio la temperatura fue analizada con un medidor digital de temperatura para el suelo, insertando la vara metálica del aparato dentro de la arena de la playa y limpiando la punta con agua destilada después de cada medición (n=18). Con estos datos, se aplicó una prueba ANOVA de un factor, considerando la distancia desde la línea de marea baja como variable independiente y la temperatura del sustrato como variable dependiente.
Se definieron los sitios de muestreo en las estacas previamente colocadas. Para ello se utilizó una cuadrícula de 25 cm x 25 cm delimitando el área para obtener muestras del sedimento. Con una pala se escarbó a 10 cm por debajo del área marcada y se tomaron las muestras de sedimento. Para separar los sólidos de la arena se utilizaron tamices con una apertura de 500 μm y los materiales retenidos fueron depositados en bolsas herméticas previamente identificadas. En el laboratorio se analizaron utilizando estereoscopios y microscopios.
Muestreo en sustrato rocoso
Desde la costa rocosa hasta la arena se definieron tres transectos colocando una cuadrícula de 25 cm x 25 cm cada 5 metros. La distancia fue medida siguiendo el recorrido del relieve rocoso utilizando una cuerda; en consecuencia, se obtuvo diferente número de sitios de muestreo en cada transecto (T1= 9, T2=5, T3=10). Se midió la temperatura y la salinidad en las piscinas de marea utilizando un medidor multiparamétrico LUTRON WA2017SD.
En cada punto se tomó una fotografía de la cuadrícula y se recolectaron especímenes de algas y macroinvertebrados bentónicos en bolsas herméticas previamente rotuladas para la posterior caracterización de las especies en el laboratorio. Para el análisis de abundancia de percebes y mejillones se realizó un conteo in situ utilizando un cálculo del porcentaje ocupado mientras que para los otros organismos se calculó el número de individuos por metro cuadrado.
Resultados y discusión
Sustrato arenoso
En la playa arenosa, la temperatura promedio total fue de 30.8 ºC, con un rango desde 26.1 ºC a 38.8 ºC. Como se muestra en la Figura 1, se promedió esta variable en cada distancia y se encontró que la temperatura del sedimento es menor (26.9 ºC) en la línea de marea baja (0 m), mientras que, la mayor temperatura (35.6 ºC) se encontró a los 30 m. A distancias de 40 m y 50 m, esta temperatura vuelve a disminuir.
Este evento también fue documentado por Celentano et al., (2019), quienes establecieron que la temperatura del sedimento arenoso disminuye hacia la zona de oleaje y en sedimentos más profundos. Al contrastar con los datos de Herrera et al. (2018) en la playa El Pelado durante julio de 2018, se registraron temperaturas de 26 ºC y 21 ºC en los dos transectos de estudio, aunque no se indica la distancia desde la línea de marea baja. Estas variaciones pueden deberse a diferentes épocas del año y horas de muestreo.

Figura 1. Temperatura del sustrato arenoso según la distancia al mar.
Antes de realizar los análisis estadísticos, se indica la independencia de mediciones de temperatura, se probó la normalidad con la prueba de Shapiro-Wilk (0.3114, p > 0.05) y se verificó la homogeneidad de varianzas a través de la prueba de Levene (0.7907, p > 0.05). Al realizar la prueba ANOVA se obtuvo un valor de 0.000201 (p < 0.05) por lo que las diferencias de temperatura según la distancia al mar son significativas.
Se procedió a realizar el método de Tukey para comparaciones múltiples obteniendo el gráfico de intervalos de confianza del 95% (ver Figura 2). Se encontró que las temperaturas a 30 m y 40 m difieren de las de 0 m, 10 m y 20 m. Es fundamental destacar que el número de muestra empleado para la temperatura puede limitar los resultados estadísticos.
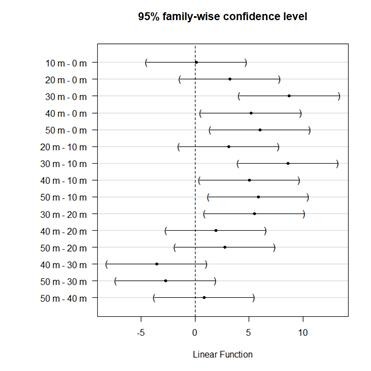
Figura 2. Comparaciones múltiples entre temperaturas a diferentes distancias del mar.
Respecto a las especies, no se calculó la abundancia en los sitios de muestreo dada la limitada frecuencia de organismos. Posiblemente, esto se justifica en factores como la pendiente, el tamaño del grano, la longitud de la costa y la temperatura que limitan la colonización (Escrivá et al., 2020). Bujan et al. (2019) señalan que las playas con mayor pendiente tienen un tamaño de grano superior y son menos impactadas por el oleaje. Esto encaja con lo indicado por Celentano et al. (2019) quienes indican que existe una menor riqueza de organismos en la zona intermareal debido al estrés por desecación. En El Pelado parece reproducirse este patrón dada la pendiente observada, la granulometría y la limitada frecuencia de organismos.
Tabla 1. Taxones registrados en el sustrato arenoso.
|
Taxones |
Conteo de individuos |
|||||
|
Arthropoda |
|
|||||
|
Excirolana baziliensis |
1 |
|||||
|
Sphaeromatidae sp. |
1 |
|||||
|
Echinodermata |
||||||
|
|
|
|
|
Asterias rubens |
1 |
|
|
Mollusca |
||||||
|
Olivella semistriata |
1 |
|||||
|
Donax mancorensis |
1 |
|||||
Entre los organismos identificados se tuvieron una estrella de mar Asterias rubens, un anélido, un gasterópodo Olivella semistriata, un bivalvo Donax mancorensis, un isópodo Excirolana braziliensis y otro del género Sphaeromatidae (Tabla 1). El estudio de Herrera et al. (2018) realizado en la misma playa, destaca la presencia de O. semistriata, D. mancorensis y poliquetos con 700, 50 y 2300 individuos por metro cuadrado respectivamente en la zona intermareal arenosa, lo cual concuerda con el presente estudio respecto a la composición, aunque difiere en la abundancia de los organismos. Asimismo, el estudio de Cárdenas et al. (2020) indica que la especie con mayor abundancia fue O. semistriata en playas arenosas de la costa ecuatoriana continental. La disminución en la presencia de especies puede obedecer a cambios temporales o ambientales no determinados en este estudio.
Sustrato rocoso
En los tres transectos del sustrato rocoso, se observó que la diversidad y abundancia de organismos encontrados variaba dependiendo de la distancia hasta la línea de marea baja. En las costas rocosas, las mareas son el principal agente modificador dado que el agua no solo baña la superficie del sustrato, sino que se filtra hacia grietas, cuevas y piscinas de marea que sirven de refugio. Estas últimas, albergan la mayor cantidad y diversidad de organismos, lo cual permite variadas interacciones interespecíficas e intraespecíficas.
Debido a la reducida cantidad de agua en las piscinas de marea, los factores fisicoquímicos son variables (Buasakaew et al., 2021). Esto se evidencia en las diferentes temperaturas y salinidades registradas en 10 piscinas de marea (ver Tabla 2). La temperatura más alta registrada fue de 37.1 ºC mientras que la más baja fue de 26.8 ºC en los transectos 2 y 3 respectivamente, a diferente distancia desde la línea de marea baja. Respecto a la salinidad, se presentó una variación desde 32 a 33.2 entre las diferentes piscinas de marea. Herrera et al. (2018) en la misma playa tuvo valores de salinidad de 35 PSU en temporada seca, lo que podría sugerir que este parámetro reduzca en las piscinas de marea durante época lluviosa.
Tabla 2. Temperatura y salinidad de las piscinas de marea de la playa El Pelado.
|
Transecto – Piscina |
Temperatura [ºC] |
Salinidad [PSU] |
|
T1 – 1 |
29.4 |
32.3 |
|
T1 – 2 |
31.2 |
33.2 |
|
T2 – 1 |
26.9 |
32.0 |
|
T2 – 2 |
37.1 |
32.8 |
|
T3 – 1 |
26.8 |
32.8 |
|
T3 – 2 |
27.5 |
32.9 |
|
T3 – 3 |
29.9 |
32.8 |
|
T3 – 4 |
30.2 |
32.5 |
|
T3 – 5 |
30.4 |
33.1 |
En la zona intermareal, se encontró la presencia de algas del género Ulva y también del género Ceramium de color rojo. Las algas Ulva se encontraron en las piscinas de marea y sobre la roca desnuda, esta especie permite la retención de agua en sus talos y es alimento de muchos organismos en la costa rocosa por lo cual su rol es fundamental en el mantenimiento del ecosistema (Quirós et al., 2013). En la zona submareal es posible observar flora y fauna adaptada a cambios permanentes en la salinidad y temperatura, y en la zona intermareal también a procesos de desecación (Zamorano, Barrientos Luján, & Ramírez-Luna, 2008). Las condiciones físicas son variables en las piscinas de marea cuyo volumen de agua es reducido, y por ello, se evidencia la mortalidad de varias especies. Por ejemplo, Little et al. (2021) indican que existe una mayor vulnerabilidad de los percebes a temperaturas menores a 14 °C mientras que Lupo et al. (2020) registraron que a una temperatura mayor a 24 ºC en el hemisferio norte, la mortalidad de los moluscos Mytilus edulis y M. galloprovincialis aumenta.
Se encontraron aproximadamente 20 piscinas de marea en las cuales hubo presencia de algas de los géneros Padina y Codium y de otros organismos propios de la zona como los erizos de mar, gasterópodos o pólipos que se pudieron visualizar al retirar los sedimentos acumulados en las piscinas. Por otra parte, en la zona intermareal media disminuyó el agua en los sitios de muestreo y hubo menor cantidad de piscinas de marea. En esta área, aumentó la cantidad de Balanus en las áreas secas de la roca.
Como se aprecia en la Tabla 3, al evaluar la zona intermareal alta se observó y se registró una gran variedad y abundancia de bellotas de mar y mejillones que competían principalmente por espacio. Además, se encontraron gasterópodos de mayor tamaño (Thais sp.) encima de estos organismos. En el momento de baja marea, los organismos quedan cubiertos por una fina capa de agua que rápidamente se evapora por lo cual las especies quedan expuestas al aire y predadores terrestres, presentándose mortandad en bellotas de mar juveniles, lapas y mejillones, por lo cual disminuye la distribución de estas especies.
Cárdenas et al. (2020) manifiestan que, en la costa ecuatoriana, la zona intermareal rocosa posee mayor biodiversidad caracterizada por algas Rhodophyta y Chlorophyta además de poliquetos, artrópodos, moluscos, equinodermos, platelmintos, poríferos y cnidarios. Aunque la playa El Pelado no estuvo considerada en el estudio, al comparar con los resultados de esta investigación, se encontró semejanza en las especies Phaeophyceae, Padina, Ulva, Codium, Chaetomorpha, Jania, Ceramium, Laurencia, Hypnea, Tetraclita squamosa, Pollicipes elegans, Chthamalus, Balanus, Echinometra vanbrunti, Acanthina brevidentata, Brachidontes adamsianus, Fissurella asperella, Vasula melones, Siphonaria maura y Tricolia.
Algunos organismos han desarrollado adaptaciones como los moluscos que incrementan su reflexión solar con las conchas blancas y los percebes que aumentan la sombra disponible para otros individuos (Moisez et al., 2020). Seuront et al. (2019) indican que una mayor exposición al aire y al sol reduce la tolerancia térmica. A partir de esto se infiere que la fauna y el hábitat pueden verse afectados por la actividad antropogénica y los eventos climáticos (Satyam & Thiruchitrambalam, 2018; Monclaro et al., 2021).
Tabla 3. Taxones registrados en el sustrato rocoso.
|
Taxones |
Cuadrículas (abundancia) |
||||||
|
Ochrophyta |
|||||||
|
Clase: Phaeophyceae 1 (Kjellman, 1891) |
T3E3 (16%) |
||||||
|
Clase: Phaeophyceae 2 (Kjellman, 1891) |
T3E4 (20%), T3E7 (4%) |
||||||
|
Clase: Phaeophyceae 3 (Kjellman, 1891) |
T3E9 (8%) |
||||||
|
|
|
|
Padina gymnospora (Adanson, 1763) |
T1E1 (12%) |
|||
|
|
|
|
Padina sp. 1 (Adanson, 1763) |
T1E1 (18%) |
|||
|
|
|
|
Padina sp. 2 (Adanson, 1763) |
T2E1 (1%) |
|||
|
Clase: Xanthophyceae 1 (Fritsch, 1935) |
T3E1 (46%) |
||||||
|
Chlorophyta |
|||||||
|
Ulva sp. 1 (Linnaeus, 1753) |
T1E1 (8%), T2E3 (12%), T2E4 (7%) |
||||||
|
Ulva sp. 2 (Linnaeus, 1753) |
T2E1 (4%), T2E2 (20%) |
||||||
|
Ulva sp. 3 (Linnaeus, 1753) |
T3E1 (29%), T3E2 (1%), T3E9 (4%) |
||||||
|
Codium sp. 1 (Stackhouse, 1797) |
T2E1 (0.25%), T2E4 (2%) |
||||||
|
Codium sp. 2 (Stackhouse, 1797) |
T3E3 (4%), T3E4 |
||||||
|
Chaetomorpha sp. (Kützing, 1845) |
T1E6 |
||||||
|
Rhodophyta |
|||||||
|
Familia: Rhodophyta (Wettstein, 1901) |
T3E3 (8%) |
||||||
|
Jania sp. (Lamoroux, 1812) |
T2E1 (68%) |
||||||
|
Heterosiphonia sp. (Montagne, 1842) |
T2E2 (30%) |
||||||
|
Ceramium sp. 1 (Roth, 1797) |
T2E2 (30%) |
||||||
|
Ceramium sp. 2 (Roth, 1797) |
T2E3 (44%) |
||||||
|
Laurencia sp. (Lamouroux, 1813) |
T2E4 (3%) |
||||||
|
Hypnea sp. (Lamouroux, 1813) |
T2E5 |
||||||
|
Nemertea |
|||||||
|
Planaria sp. 1 (Müller, 1776) |
T1E5 |
||||||
|
Planaria sp. 2 (Müller, 1776) |
T1E7 |
||||||
|
Annelida |
|||||||
|
Clase: Polychaeta (Grube, 1850) |
T2E5 |
||||||
|
Arthropoda |
|||||||
|
Tetraclita squamosa (Bruguière, 1789) |
T1E3 (36%), T1E4(48%), T1E5 (24%), T1E6 (8%), T1E8 (28%) |
||||||
|
Pollicipes elegans (Lesson, 1831) |
T1E6 (1%) |
||||||
|
Chthamalus sp. (Ranzani, 1817) |
T2E2 (4%) |
||||||
|
Balanus sp. 1 (Costa, 1778) |
T2E5 (4%) |
||||||
|
Balanus sp. 2 (Costa, 1778) |
T3E1 (1%) |
||||||
|
|
|
|
|
Balanus sp. 3 (Costa, 1778) |
T3E7 (40%) |
||
|
Infraorden: Brachyura (Latreille, 1802) |
T2E2 (4 ind/m2), |
||||||
|
Cnidaria |
|||||||
|
Clase Anthozoa (Ehrenberg, 1834) |
T2E4 (7%) |
||||||
|
Familia Actiniidae (Rafinesque, 1815) |
T2E4 |
||||||
|
Echinodermata |
|||||||
|
Echinometra vanbrunti (Agassiz, 1863) |
T2E1 (12 ind/m2) |
||||||
|
Mollusca |
|||||||
|
Clase Gastropoda (Cuvier, 1795) |
|||||||
|
|
|
|
|
Acanthais brevidentata (Wood, 1828) |
T1E2 (4%), T1E6, T2E1 (20 ind/m2) |
||
|
|
|
|
|
Fissurella asperella (Sowerby, 1835) |
T1E5 |
||
|
|
|
|
|
Thais sp. (Röding, 1798) |
T1E8 |
||
|
|
|
|
|
Vasula melones (Duclos, 1832) |
T1E6, T1E7 (16%), T1E8, T1E9 |
||
|
|
|
|
|
Lepeta sp. (Gray, 1842) |
T1E7 (0.05%) |
||
|
|
|
|
|
Littorina sp. 1 (Férussac, 1822) |
T1E3, T1E5 |
||
|
|
|
|
|
Littorina sp. 2 (Férussac, 1822) |
T1E6, T3E1 (0.16%) |
||
|
|
|
|
|
Littorina sp. 3 (Férussac, 1822) |
T1E9 |
||
|
|
|
|
|
Littorina sp. 4 (Férussac, 1822) |
T2E2 (20 ind/m2) |
||
|
|
|
|
|
Littorina sp. 5 (Férussac, 1822) |
T2E4 (24 ind/m2) |
||
|
|
|
|
|
Siphonaria maura (Sowerby, 1835) |
T1E2 (16%), T1E4 (8%), T2E2 (1%) |
||
|
|
|
|
|
Buccinum sp. (Linnaeus, 1758) |
T2E5 (2%) |
||
|
|
|
|
|
Tricolia sp. (Risso, 1826) |
T2E5 (2%) |
||
|
|
|
Familia Olividae 1 (Latreille, 1825) |
T2E3 (12 ind/m2) |
||||
|
|
|
Familia Olividae 2 (Latreille, 1825) |
T2E2 (40 ind/m2) |
||||
|
|
Clase: Bivalvia (Linnaeus, 1758) |
||||||
|
|
|
|
|
Brachidontes adamsianus (Dunker, 1857) |
T1E3 (12%), T1E5 (52%), T1E6 (38%), T1E8 (12%) |
||
|
|
|
|
|
Mytilus sp. 1 (Linnaeus, 1758) |
T2E5 (4%), T3E1 (15%) |
||
|
|
|
|
|
Mytilus sp. 2 (Linnaeus, 1758) |
T3E1 (2%), T3E7 (48%), T3E8 (30%), T3E9 (44%) |
||
|
|
|
|
|
Mytilus sp. 3 (Linnaeus, 1758) |
T3E4 (4%) |
||
|
|
|
Familia: Ostrea (Linnaeus, 1758) |
T3E10 (0.4%) |
||||
|
|
|
Familia: Donacidae (Fleming, 1828) |
T3E4 (32%) |
||||
En los 3 transectos se registró abundancia de Mytilus sp., seguido por diferentes tipos de algas. La presencia de estas dos especies en el mismo ecosistema se ve justificada debido a que las algas poseen componentes fenólicos que son favorables para la fijación del mejillón. Fales et al. (2020) indican que ambas especies son consideradas ingenieras del ecosistema debido a que forman hábitats para otros organismos y, a su vez, modifican las condiciones ambientales.
De igual manera, en los transectos con mejillones (Mytilus) se registra la presencia de bellotas de mar (Balanus). Entre estos existe una relación epibiótica en la cual los percebes se fijan sobre los mejillones por el resto de su vida. Puccinelli y McQuaid (2021) indican que estos organismos compiten por espacio y por alimento dado que ambos son organismos filtradores, incluso las bellotas de mar registran una menor calidad en la alimentación al colonizar las conchas de los mejillones.
En los transectos 2 y 3 se registró presencia de poliquetos en piscinas de marea, estos estuvieron asociados a algas que cumplen una función protectora ante el impacto del oleaje. Quirós et al. (2013) establecen que el parámetro que más afecta a ambas especies es la intensidad solar a la cual se verían expuestas en zonas secas de la roca.
Se encontraron gasterópodos en los tres transectos analizados. Estos organismos son comunes en las costas rocosas y han desarrollado la concha como una estructura que les permite sobrevivir a los cambios bruscos de temperatura y salinidad que afectan a la zona intermareal (Lagos et al., 2021). Respecto a las interacciones interespecíficas, las familias Thaididae, Buccinidae y Phasianellidae ejercen depredación sobre otras especies (Avendaño et al., 2023; Yamakami & Satoshi, 2021). Por otra parte, la familia Littorinidae registrada es herbívora, se alimentan mayoritariamente de algas y habitan en ambos hemisferios distribuyéndose en Sudamérica, Nueva Zelanda, Australia, Tasmania y la Antártida (Rosenfeld et al., 2022).
Al comparar entre ambos sustratos, se observó una mayor presencia de organismos filtradores en la playa rocosa a diferencia de la playa arenosa donde se encuentran organismos que se alimentan de los nutrientes presentes entre la arena. La principal diferencia entre estos espacios es el sustrato al cual pueden colonizar. En las piscinas de marea y sustratos rocosos los organismos tienen la facilidad de adherirse a una superficie definida, mientras que en la playa arenosa los organismos tendrán que enterrarse para evitar ser transportados por la marea. Además, en las costas rocosas, los organismos tendrán la posibilidad de alimentarse de las microalgas y el “biofilm” que se va formando en la roca, derivando en una mayor disponibilidad de nutrientes, mayor diversidad de especies y mayor competencia por colonizar sustratos con respecto al ambiente arenoso.
A pesar de que la desecación representa un desafío en ambos ambientes, los organismos muestran adaptaciones morfológicas eficaces para enfrentarla, como la capacidad de enclaustrarse. Además, las variaciones en temperatura y salinidad son factores que influyen en la biodiversidad debido a las adaptaciones fisiológicas que deben desarrollar los organismos de ambientes rocosos para tolerar el incremento en la salinidad en el caso que estos se encuentren en una piscina de marea.
Conclusiones
El presente estudio aporta información inédita sobre la biodiversidad intermareal en Playa El Pelado en la temporada lluviosa, estableciendo una línea base necesaria para el monitoreo ecológico y la gestión costera. Los resultados muestran las diferencias en las poblaciones de organismos bentónicos en las diferentes zonas estudiadas, siguiendo el patrón de variaciones entre playas arenosas y los sustratos rocosos.
La diversidad específica observada refleja evidentemente diferencias ambientales. En la playa arenosa, la identificación se limitó a dos especies de isópodos, una estrella de mar, un bivalvo del género Donax, un gasterópodo O. semistriata y un anélido. Por el contrario, la plataforma rocosa albergaba una amplia variedad de especies, incluidas algas (Codium, Ulva, Padina), diversos gasterópodos como Littorina, erizos del mar, estrellas de mar, anémonas, percebes, balanos, poliquetos, planarias, patelas y mejillones.
Los factores limitantes principales en el ambiente rocoso incluyen parámetros fisicoquímicos como salinidad y temperatura, especialmente relevantes en las piscinas de marea, que funcionan como reservorios de biodiversidad. Para la playa arenosa, la pendiente y el tamaño de grano toman mayor importancia dado que influencia en la retención de humedad y la disponibilidad de nutrientes, lo que resulta en un ambiente más restrictivo para la colonización. La baja riqueza observada en el sustrato arenoso parece responder principalmente a factores físicos propios del ambiente, sin embargo debe considerarse que la ausencia de grupos sensibles podría también ser efecto de las presiones antropogénicas locales.
Las interacciones ecológicas fueron mayormente notables en las zonas rocosas, donde se evidenció una clara zonación de especies según sus adaptaciones y necesidades. Las interacciones bióticas incluyeron competencia por espacio en la zona intermareal alta, principalmente entre mejillones y balanos, y competencia por luz y espacio entre las algas pertenecientes a la zona intermareal baja y en las piscinas de marea. La depredación también juega un papel importante, especialmente por parte de anémonas y ciertos gasterópodos sobre organismos herbívoros.
Para futuras investigaciones, se sugiere implementar una base de datos sobre la riqueza y diversidad asociada a la zona intermareal de la playa El Pelado. Asimismo, se requiere ampliar el análisis y monitoreo de parámetros fisicoquímicos, incluyendo el pH, oxígeno disuelto y nutrientes en las piscinas de marea, ya que estos factores podrían influir en la distribución de los organismos. Por último, se propone desarrollar programas de monitoreo permanente que permitan evaluar los efectos de las actividades antropogénicas y el cambio climático sobre las comunidades intermareales, especialmente en relación con el aumento de la temperatura y los cambios en los patrones de marea, incluyendo las variaciones estacionales en las épocas lluviosa y seca.
Conflicto de intereses
Los autores declaran que no existe conflicto de intereses.
Contribución de los autores
Conceptualización, G.Q. y A.K.; Metodología, F.M. A.D. y J.O.; Investigación, G.Q. y A.K.; Redacción del borrador, G.Q., A.K.; Redacción y correcciones, F.M.; Supervisión, F.M.
Referencias bibliográficas
1. Afghan, A., Cerrano,
C., Luzi, G., Calcinai, B.,
Puce, S., Pulido, T., Roveta,
C., Di Camillo, C. (2020). Main Anthropogenic Impacts on Benthic Macrofauna of Sandy Beaches: A
Review. Journal of
Marine Science and Engineering, 8(6), 405. https://doi.org/10.3390/jmse8060405
2. Avendaño, M., Cantillanez, M., Oliva, M., & González, M. (2023). Changes in the distribution density
of locate, Thaisella chocolata (Duclos, 1832) (Gastropoda,
Thaididae) as an indicator for predicting their
reproductive events. Latin American Journal of Aquatic Research, 51(2),
238-247. http://dx.doi.org/10.3856/vol51-issue2-fulltext-2985
3. Barbier, E., Hacker, S., Kennedy, C., Koch, E.,
Stier, A., & Silliman, B. (2011). The value of estuarine and coastal ecosystem services. Ecological
monographs, 81(2), 169-193. https://doi.org/10.1890/10-1510.1
4. Barboza, F., & Defeo, O. (2015).
Global diversity patterns in sandy beach macrofauna: a biogeographic analysis. Scientific
Reports, 5, 14515. https://doi.org/10.1038/srep14515
5. Buasakaew, N., Chan, B., Wangkulangkul,
K. (2021). Why Are Barnacles Common on Intertidal Rocks but Rare in Rock Pools?
Effect of Water Temperature, Salinity, and Continuous Submergence on Barnacle
Survival in Indian Ocean Rock Pools. Frontiers in Marine Science, 8, 688894.
https://doi.org/10.3389/fmars.2021.688894
6. Bujan, N., Cox, R., & Masselink, G. (2019). From fine sand to boulders: Examining the relationship between beach-face slope and sediment size. Marine Geology, 417, 106012. https://doi.org/10.1016/j.margeo.2019.106012
7. Cárdenas, M., Mora, E., Torres, G., Pérez, J., Bigatti, G., Signorelli, J., & Coronel, J. (2020). Marine invertebrate and seaweed biodiversity of continental coastal Ecuador. Biodiversity Data Journal, 8, e53818. https://doi.org/10.3897/BDJ.8.e53818
8. Celentano, E., Lercari, D., Maneiro, P., Rodríguez, P., Gianelli, I., Ortega, L., Orlando, L., & Defeo, O. (2019). The forgotten dimension in sandy beach ecology:
Vertical distribution of the macrofauna and its environment. Estuarine,
Coastal and Shelf Science, 217, 165-172. https://doi.org/10.1016/j.ecss.2018.11.008
9. Escrivá,
J., Rodilla, M., Martin, J., Estruch, V., Sebastiá,
M., Llario, F., & Falco, S. (2020). Driving forces that
structure sublittoral macrobenthic communities in
sandy beaches along environmental gradients. Estuarine, Coastal and Shelf
Science, 233, 106517. https://doi.org/10.1016/j.ecss.2019.106517
10. Fales, R., Boardman, F., & Ruesink, J. (2020). Reciprocal
Interactions between Bivalve Molluscs and Seagrass: A Review and Meta-Analysis.
Journal of Shellfish Research, 39(3), 547-562. https://doi.org/10.2983/035.039.0305
11. Ferrer, J. (2023). On the Rocks, Below the Rocks: A study of intertidal
life in the low, middle and high zones of the Puerto Cabuyal
– Punta San Clemente Marine Reserve during an El Niño event. Independent
Study Project (ISP) Collection, 3676.
https://digitalcollections.sit.edu/isp_collection/3676
12. Harris, L., & Defeo, O. (2022). Sandy shore ecosystem services,
ecological infrastructure, and bundles: New insights and perspectives.
Ecosystem Services, 57, 101477. https://doi.org/10.1016/j.ecoser.2022.101477
13. Hawkins, S., Pack, K., Hyder, K., Benedetti-Cecchi, L., & Jenkins, S. (2020). Rocky shores as tractable test systems for experimental ecology. Journal of the Marine Biological Association of the United Kingdom, 100(7), 1017–1041. https://doi.org/10.1017/S0025315420001046
14. Herrera, A., Piedrahita, P., & Calle, P. (2018).
Notas Ecológicas
Preliminares sobre Macro-fauna Bentónica y su
Relación con Aves Playeras. INVESTIGATIO, (11), 57–66. https://revistas.uees.edu.ec/index.php/IRR/article/view/173
15. Johnson, M. (2024). Ecology of Intertidal Rocky Shores Related to
Examples of Coastal Geology across Phanerozoic Time. Journal of Marine
Science and Engineering, 12(8), 1399. https://doi.org/10.3390/jmse12081399
16. Lagos, N., Benítez, S., Grenier, C., Rodriguez, A.,
García, C., Abarca, A., Vivanco, J., Benjumeda, I., Vargas, C., Duarte, C.
& Lardies, M. (2021). Plasticity in organic composition maintains
biomechanical performance in shells of juvenile scallops exposed to altered
temperature and pH conditions. Scientific Reports, 11(1),
24201. https://doi.org/10.1038/s41598-021-03532-0
17. Leeuwis, R., & Gamperl, A. (2022). Adaptations and
plastic phenotypic responses of marine animals to the environmental challenges
of the high intertidal zone. In Oceanography and Marine Biology, 60 (pp.
625-679). CRC Press. https://doi.org/10.32942/osf.io/jq34u
18. Little, C., Trowbridge, C., Williams, G., Hui, T., Pilling, G., Morritt,
D., & Stirling, P. (2021). Response of intertidal barnacles to air
temperature: Long-term monitoring and in-situ measurements. Estuarine,
Coastal and Shelf Science, 256, 107367. https://doi.org/10.1016/j.ecss.2021.107367
19. Lupo, C., Bougeard, S., Le Bihan, V., Blin,
J., Allain, G., Azéma, P., Benoit, F., Béchemin, C., Bernard, I., Blachier,
P., Brieau, L., Danion, M., Garcia, A., Gervasoni,
E., Glize, P., Lainé, A., Lapègue, S., Mablouké, C.,
Poirier, L., Raymond, J., Treilles, M., Chauvin, C.
and Le Bouquin, S. (2020). Mortality of marine mussels Mytilus edulis
and M. galloprovincialis: systematic
literature review of risk factors and recommendations for future research. Reviews
in Aquaculture, 13(1), 504-536. https://doi.org/10.1111/raq.12484
20. Moisez, E., Spilmont, N., Seuront,
L. (2020). Microhabitats choice in intertidal gastropods is species-,
temperature- and habitat-specific. Journal of Thermal Biology, 94, 102785.
https://doi.org/10.1016/j.jtherbio.2020.102785
21. Monclaro, I., Bertocci, I., Paiva, P., & Menezes, M. (2021). Natural and anthropogenic factors as
possible drivers of variability in rocky shore assemblages at multiple spatial
scales. Estuarine, Coastal and Shelf Science, 262, 107577. https://doi.org/10.1016/j.ecss.2021.107577
22. Nascimento, G., & Zacagnini, A. (2023). Benthic Invertebrate Macrofauna. In: Zacagnini , A., Checon, H., Nascimento, G. (eds) Brazilian Sandy
Beaches. Brazilian Marine Biodiversity. Springer, Cham. https://doi.org/10.1007/978-3-031-30746-1_4
23. Quirós, J., Dueñas, P., & Hernando, N. (2013). Poliquetos (Annelida: Polychaeta) asociados a algas rojas intermareales de Córdoba, Caribe Colombiano. Revista de Biología Marina y Oceanografía, 48(1), 87-98. http://dx.doi.org/10.4067/S0718-19572013000100008
24. Rosenfeld, S., Maturana, C.,
Spencer, H., Convey, P., Saucède, T., Brickle, P.,
Bahamonde, F., Jossart, Q., Poulin, E., & Gonzalez, C. (2022). Complete distribution of the
genus Laevilitorina (Littorinimorpha, Littorinidae)
in the Southern Hemisphere: remarks and natural history. Zookeys,
2(1127), 61-77. https://doi.org/10.3897/zookeys.1127.91310
25. Satyam, K., & Thiruchitrambalam, G. (2018). Habitat Ecology and Diversity
of Rocky Shore Fauna. In: Sivaperuman, C., Velmurugan,
A., Jaisankar, I. (eds) Biodiversity and Climate
Change Adaptation in Tropical Islands. Academic Press. https://doi.org/10.1016/C2016-0-04301-2
26. Seuront, L., Nicastro, K., Zardi,
G., & Goberville, E. (2019). Decreased thermal tolerance under
recurrent heat stress conditions explains summer mass mortality of the blue
mussel Mytilus edulis. Scientific Reports, 9, 17498. https://doi.org/10.1038/s41598-019-53580-w
27. Sibaja, J., & Troncoso, J. (2024). Gradual change and mosaic pattern
of macrofaunal assemblages along depth and sediment gradients in a tropical
oceanic island. Neotropical Biology and Conservation, 19(2), 293-318. https://doi.org/10.3897/neotropical.19.e117876
28. Yamakami, R. & Satoshi, W. (2021). Prey utilization
by Neptunea arthritica
(Caenogastropoda: Buccinidae):
predation on gastropods and size-related variation. Journal of Molluscan
Studies, 87(2), eyab016. https://doi.org/10.1093/mollus/eyab016
29.
Zamorano, P., Barrientos, N., & Ramírez,
S. (2008). Malacofauna del infralitoral
rocoso de Agua Blanca, Santa Elena Cozoaltepec,
Oaxaca. Ciencia y Mar, 12(36), 19-33.
