RESUMEN
El suelo cacaotero en el Ecuador alberga una
biodiversidad de microorganismos benéficos que aún no han sido estudiados;
tales como, los hongos micorrízicos arbusculares (HMA) que a través de la
simbiosis mutualista tienen una estrecha relación en la adaptación y desarrollo
del cultivo de cacao. El objetivo de esta investigación fue aislar e
identificar la presencia de HMA en tres fincas productoras de cacao orgánico
bajo sistema agroforestal y una finca de manejo convencional o química en
plantas entre rangos de 1-10 y 11-20 años de edad, provenientes del cantón
Vinces-Ecuador. Se recolectaron muestras de suelo para determinar parámetros
físicos-químicos como textura, humedad de suelo, pH, contenido de fósforo,
además del contenido de esporas y la caracterización morfológica de HMA; a su
vez, se tomaron muestras de raíces para determinar el porcentaje de
micorrización. Los resultados demuestran que las plantas entre 1-10 años de
edad de la finca I presentaron mejores resultados con 80,7% del porcentaje de
micorrización y 159 esporas en 100 g de suelo; mientras que, la finca IV, en
plantas de 1-10 años de edad, presentaron los menores valores con 36,0% de
porcentaje de micorrización y 37 esporas en 100 g de suelo; no obstante, la
clase textural del suelo, pH y nivel de fósforo de las cuatro fincas fueron
similares. Se identificaron a nivel de esporas de HMA los géneros Acaulospora,
Claroideoglomus, Funneliformis y Pacispora. Concluyendo
que la diversidad de HMA en el suelo puede ser favorecida bajo sistemas
agroforestales asociadas al cultivo de cacao.
Palabras claves: Cacao, micorrización, rizósfera, simbiosis.
ABSTRACT
The cocoa soil in Ecuador harbors a
biodiversity of beneficial microorganisms that have not yet been studied; such
as, the arbuscular mycorrhizal fungi (AMF) that through the mutualist symbiosis
have a close relationship in the adaptation and development of the cocoa crop.
The objective of this research was to isolate and identify the presence of AMF
in three farms producing organic cocoa under an agroforestry system and farm
with conventional or chemical management in plants between 1-10 and 11-20 years
of age from the canton of Vinces-Ecuador. Soil samples were collected to
determine physical-chemical parameters such as texture, soil moisture, pH,
phosphorus content, in addition to the spore content and the morphological
characterization of AMF; In turn, root samples were taken to determine the
percentage of mycorrhization. The results show that the plants between 1-10
years of age of the farm I presented better results with 80.7% of the
percentage of mycorrhization and 159 spores in 100 g of soil; whereas, farm IV,
in plants of 1-10 years of age, presented the lowest values with 36.0%
percentage of mycorrhization and 37 spores in 100 g of soil; however, the
textural class of the soil, pH and phosphorus level of the four farms were
similar. The genera Acaulospora, Claroideoglomus, Funneliformis and Pacispora were identified at
the AMF spore level. Concluding that the diversity of AMF in the soil can be
favored under agroforestry systems associated with the cultivation of cocoa.
Keywords: Cocoa, mycorrhization, rhizosphere, symbiosis.
Introducción
Durante más de un siglo el cacao (Theobroma cacao
L.) ha sido uno de los cultivos de mayor importancia económica en el Ecuador,
siendo la provincia de Los Ríos, una de las más productoras, donde suele ser el
ingreso económico principal de muchas familias (Carranza et al., 2020).
En Ecuador, el cacao es considerado símbolo del país.
Su importancia, en décadas anteriores, fue tal, que llegó a ser la principal
fuente de generación económica y social del país, mientras que, actualmente,
está dentro de los tres países más productores a nivel mundial, con una
proyección de subir hasta el segundo lugar, superando a Ghana en 2024 (García,
Pico y Jaimez, 2021; Paredes, et al., 2021; ANECACAO 2024).
Este cultivo es uno de los más adaptados a las
condiciones climáticas de la región amazónica ecuatoriana, donde su fruto, es
utilizado como materia prima para la exportación y elaboración de chocolate de
empresas reconocidas a nivel local e internacional (Paredes, et al.,
2022).
Los cultivos transitorios provocan una pérdida
acelerada de macro y micronutrientes, lo que lleva a la dependencia de insumos
agrícolas (Paredes, et al., 2021). Las prácticas agrícolas
convencionales a gran escala, por lo general, dependen en gran medida de los
insumos fertilizantes químicos, mientras que se pasa por alto, el gran papel
que cumplen los microbiomas en distintos aspectos, como la absorción de agua y
nutrientes del suelo por parte de las plantas (Busayo, et al., 2022).
Sin embargo, en la rizosfera de las plantas de cacao
existe una diversidad de microorganismos benéficos que intervienen en la
absorción de agua, nutrientes, producción de reguladores de crecimiento e
incluso en la protección contra enfermedades de forma natural (Utomo et al.,
2016).
Esto se da a través del proceso conocido como
simbiosis, donde se encuentran los Hongos Micorrízicos Arbusculares (HMA)
asociados a las raíces de las plantas de cacao, siendo estos, un componente
esencial de los ecosistemas naturales y agrícolas, debido a que pueden
colonizar las raíces de la mayoría de las plantas, considerándose así, como
factores importantes para mejorar los procesos fisiológicos de la planta
huésped (Runzhi, et al., 2020; Pacheco et al., 2022).
La simbiosis de los HMA en plantas de cacao demuestra
ser beneficiosa para el crecimiento de las plantas, favoreciendo el desarrollo
de las mismas, además de un aumento de la biomasa radicular, repercutiendo en
una mayor absorción del fósforo y agua del suelo (Cuadros, Gómez y Rodríguez,
2011; Agele et al., 2018).
La principal función de esta asociación simbiótica, es
el intercambio de nutrientes; la planta le brinda al hongo carbono que adquirió
fotosintéticamente y el hongo ofrece principalmente nitrógeno y fósforo
(Carrillo, et al., 2022).
Los hongos micorrízicos arbusculares (HMA) desempeñan
roles importantes en el ciclo de carbono (C), nitrógeno (N) y fósforo (P) en
los ecosistemas terrestres (Yunfeng et al., 2022), influyendo también,
indirectamente, en la germinación de las semillas e incluso en la defensa de
las plantas contra factores como el estrés abiótico y biótico (Naranjo et al.,
2022).
En las zonas tropicales las micorrizas arbusculares
desempeñan funciones importantes en los ecosistemas naturales y agrícolas. En
ambientes naturales los HMA están involucrados en la estructuración de las
comunidades microbianas que se desarrollan en la rizosfera de plantas (Cardoso,
Nogueira y Zangaro, 2017).
Cuando los suelos son alterados por acción
antropogénica pueden existir secuelas en la población de los HMA (Cardoso,
Nogueira y Zangaro, 2017; Bertolini et al., 2018); sin embargo, es
importante mencionar que las micorrizas han sobrevivido en los sistemas
agroforestales tradicionales durante años, permaneciendo prácticamente en
lugares perturbados, cumpliendo igualmente sus funciones, siendo importantes,
también, por ejemplo, en la restauración de la vegetación nativa en hábitats
perturbados por la conexión de las plantas con sus simbiontes fúngicos (Gooden,
Thompson & Francés, 2020).
Según Albornoz et al., 2021, solamente el 1% de
las especies vegetales, han sido evaluadas, por lo que el tipo de micorrizas en
la mayoría de las plantas solo ha sido inferido. Este desconocimiento de la
presencia de las micorrizas arbusculares en los sistemas de producción
agrícola, conociendo ya los beneficios de estos hongos, ha ido generando un
aumento en las investigaciones con este tipo de asociaciones, especialmente, en
zonas tropicales, donde se cree hay mayor presencia de HMA (Pacheco et al.,
2022; Álvarez et al., 2021).
En los suelos cacaoteros del cantón Vinces, provincia
de Los Ríos no existen reportes sobre la presencia de hongos micorrízicos
arbusculares por lo que resulta importante conocer la presencia de las
micorrizas en estos suelos; dado que, parte de las zonas cultivas en este
cantón, se dedican a la producción de este cultivo. Con los antecedentes antes
expuestos, esta investigación se planteó como objetivo de identificar la
presencia de HMA en diferentes fincas productoras de cacao en la zona de
Vinces, Ecuador.
Materiales y Métodos
2.1
Sitios de muestreo
Las muestras de suelo y raíces fueron recolectadas en
el cantón Vinces, provincia de Los Ríos, que posee temperatura promedio de 26
ºC, altura de 14 m.s.n.m. y precipitación promedio anual de 1680 mm. Para el
estudio se seleccionaron cuatro fincas, tres de estas con nula aplicación de
agroquímicos (orgánica) y una convencional o química. Las fincas poseen plantas
de cacao CCN-51; en donde, para recolectar las muestras se separaron según su
ciclo vegetativo que comprendían entre rangos de 1-10 y 11-20 años de edad, con
el fin de conocer si existía una mayor o menor micorrización y concentraciones
de esporas, según la edad de las plantas. La finca I está ubicada en la
parroquia Antonio Sotomayor (1°38'25'' S 79°46'50'' O), la finca II en el
recinto San Juan de Abajo (1°33'24'' S 79°43'10 O''), la finca III en el
reciento Máximo Guizasola (1°33'29'' S 79°44'5 O'') y la finca IV convencional
o química en el recinto Santa Mariana (1°33'35'' S 79°44'7 O'').
2.2 Recolección de muestras
Las muestras fueron recolectadas en el mes de mayo del
2017, se tomaron cinco muestras compuestas de suelo y raíces, según el rango de
edad establecido. Cada muestra fue tomada a una distancia de 20 cm con respecto
al tronco, a una profundidad de 20 cm. Se separó 1 kg de suelo por cada finca,
para realizarles un análisis físico-químico, las muestras restantes fueron
utilizadas para realizar el conteo de esporas y porcentaje de micorrización.
2.3 Análisis físico-químico de los suelos
estudiados
Se enviaron las muestras de suelo al Instituto
Nacional Autónomo de Investigaciones Agropecuarias (INIAP) para conocer sus
características físico-químicas. Los parámetros analizados fueron: textura y
humedad del suelo, materia orgánica por el método de titulación de Welkeley
Black, pH por suspensión del suelo: agua 1:2.5, conductividad eléctrica a
través del conductímetro y fósforo por el método Olsen modificado.
2.4 Conteo de esporas de HMA
Se realizó mediante el método de tamizado y
decantación en húmedo propuesto por Gerdemann y Nicolson (1963), pesando 100 g
de suelo en un vaso precipitado de 1000 mL para luego completarlo con agua,
luego se efectuó la decantación por los tamices de 500 μm, 75 μm y 45 μm; esta
decantación se realizó tres veces. Lo sedimentado en el tamiz de 45 μm se
depositó en tubos falcón de 50 mL para completar con agua hasta los 45 mL. Los
tubos falcón pasaron a la centrifuga (modelo Sorvall™ Legend™ XT/XF marca Thermo
Scientific™) y dejados por 5 min a 5000 rpm a 28 ºC. Se retiró los tubos de la
centrifuga para remplazar por 10 mL de Tween 20 y nuevamente llevados a la
centrifuga. Posteriormente, se retiró el sobrenadante para para realizar el
conteo de las esporas usando el estereoscopio.
2.5 Tinción de raíces y porcentaje de
micorrización
El procedimiento de tinción de raíces se utilizó el
propuesto por Phillips y Hayman (1970) modificados por Kormanik et al.
(1979). Las raíces se lavaron con agua, fueron sumergidas en KOH al 10% durante
24 horas, luego se lavó el KOH de las raíces para sumergirlas en peróxido de
hidrogeno por 20 minutos, posteriormente en HCL al 1% por 5 minutos. Pasado el
tiempo de estar sumergidas en HCL se agregó azul de tripano al 0,05% en
lactoglicerol y se autoclavaron las raíces por 10 min a 121 ºC (15 lb de
presión). Las raíces fueron colocadas en portaobjetos para determinar el
porcentaje de micorrización (% MIC) a través de la fórmula propuesta por
McGonigle et al. (1990).
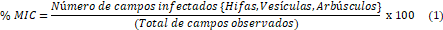
2.6 Identificación morfológica de las esporas
de hongos micorrízicos arbusculares
El criterio de identificación morfológica de los
géneros de HMA se consideró características de color, forma, tamaño, número de
paredes o capas que forman la espora y la unión o presencia de hifa
suspensoria. Como referencia se usaron las investigaciones de Goto et al.
(2008), Pereira et al.
(2015), Pérez-Luna et al. (2016), Sánchez-Roque et al. (2016) e INVAM (2017).
2.7 Análisis estadístico
No se utilizó un diseño experimental, se realizó una
comparación entre el número de esporas y porcentaje de micorrización de las
tres fincas con manejo orgánico y la testigo con manejo convencional. Los datos
fueron analizados por el procedimiento estándar de análisis de varianza
(ANDEVA) mediante el software estadístico IBM SPSS Statistics versión. La
diferencia significativa para la separación de medias de los tratamientos, se
realizó por la prueba de Tukey (p≤ 0,05%).
Resultados y Discusión
3.1 Caracterización morfológica de HMA
presente en el suelo de las fincas
Las muestras de suelo que se recolectaron de las
cuatro fincas, se logró identificar los siguientes géneros y especies de
micorrizas arbusculares como se muestra en la Figura 1. Los géneros
encontrados corresponden a Acaulospora bireticulata, Acaulospora
excavata, Claroideoglomus lamellosum, Funneliformis coronatum,
Funneliformis geosporum y Pacispora boliviana.
Acaulospora bireticulata fue identificada por el diámetro, que osciló
entre los 112,5 µm, además de poseer tres capas, la externa (1 µm), la interna
(2,5 µm) y la media (10 µm), sus colores fluctuaron entre amarillo a café claro
amarillento (Tomio et al., 2008). Sánchez-Roque et al. (2016)
encontraron la especie Acaulospora excavata en suelos de plantas
orgánicas de Coffea arábica, esta especie se caracteriza por presentar
un diámetro de 105-112,5 µm, agujeros y ornamentaciones en la superficie de la
espora de 7,5 µm de diámetro, una pared con un tamaño de 5 µm y color de las
esporas fluctuaron de amarillo ocre a anaranjado claro (Pereira et al.,
2015; Pérez-Luna et al., 2016).
Claroideoglomus lamellosum poseía un diámetro de 122,5 µm, presento dos
capas visibles que la recubren, una capa externa (5 µm), la capa media (2 µm) y
no se pudo observar claramente a la capa interna, por lo que encuentra muy
unida a la capa media, característico de esta especie, los colores de las
esporas fueron entre crema y amarillo pálido (Jean-Martial et al., 2013;
INVAM, 2017). La especie Funneliformis coronatum su promedio en el
diámetro fue de 95 µm, mostró 2 capas claramente visibles, la capa hialina
externa (3 µm) y la capa interna de color amarillo grisáceo (2 µm),
características de esta especie; sin embargo, los colores oscilaron de amarillo
pálido a café claro (INVAM, 2017), además en estudios con esta especie se ha
comprobado que posee la capacidad de producir mayor cantidad de glicoproteína
(glomalina) (Sharma et al., 2017).
Funneliformis geosporum presentó un diámetro de 120 µm, la capa
externa hialina de 1 µm de grosor, capa media amarillo o naranja de 6 µm y la
capa interna amarilla pálida de 1,5 µm, la coloración de las esporas entre
amarillo y naranja (INVAM, 2017), en México se ha reportado la presencia de
esta especie asociada al cultivo de Saccharum officinarum L. en suelo
con pH entre 6,5 a 7,0 (Sanchez-Lizarraga et al., 2017). La especie Pacispora
boliviana ha sido reportada con la siguientes características de poseer un
diámetro entre 80 µm y 107,5 µm, además la capa externa hialina (2 µm), la capa
media (4 µm) y la capa interna (2 µm) con colores desde amarillo pálido a una
tonalidad de color naranja, la presencia de ornamentaciones y agujeros en la
superficie de la espora (Oehl y Sieverding, 2004), similares a la encontrada en
este estudio, además ha sido reportadas en zonas de Sudamérica como Bolivia y
en Ecuador en suelos provenientes bosques del trópico húmedo con niveles medio
de nitrógeno y fósforo (Aragão et al., 2013; Moína-Quimí et al.,
2018).
Estos géneros identificados son semejantes a los
reportados por Rojas-Mego et al. (2014), quienes investigaron la
abundancia y diversidad de HMA asociados al cultivo de cacao en tres
agroecosistemas de la Amazonía de Perú; en donde, las especies pertenecían a
los géneros Acaulospora, Claroideoglomus, Ambispora, Glomus
y Archeospora.
Moína-Quimí et al. (2018), reportaron la
presencia de micorrizas arbusculares en zonas del trópico húmedo del Ecuador
del género Acaulospora, Ambispora, Claroideoglomus, Diversispora,
Funneliformis, Glomus y Pacispora, en plantas de cacao (Theobroma
cacao), banano (Musa spp.) y niguito (Muntingia calabura),
estos géneros reportados son similares a los encontrados en las cuatro fincas
del cantón Vinces asociados a las plantas de cacao. En este contexto, Lacatela et
al. (2017), en suelo del cantón Babahoyo de la provincia de Los Ríos en
plantas de cacao CCN-51, observaron la presencia los géneros Acaulospora
mellea, Glomus mosseae, Glomus fasciculatum y Gigaspora
gigantea bajo sistema agroforestales.
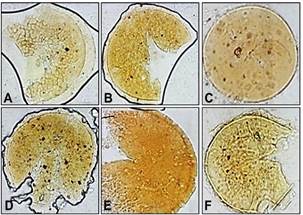
Figura 1. Esporas de hongos micorrízicos
arbusculares observadas a 100x. A: Acaulospora bireticulata; B: Acaulospora
excavata; C: Claroideoglomus lamellosum; D: Funneliformis
coronatum; E: Funneliformis geosporum; F: Pacispora boliviana.
3.2 Cantidad de esporas de HMA presentes en
las fincas
Las concentraciones de esporas en
la finca I en los rangos de edad entre 1-10 y 11-20 presentaron una mayor
concentración de 165 y 152 esporas/100 g de suelo respectivamente, como se
observa en la Figura 2, presentando diferencia estadística significativa
en comparación a la finca IV que se realiza su producción de manera
convencional. Las concentraciones de esporas en la finca I se deben
posiblemente a la diversidad de especies asociadas a las plantas de cacao,
encontrando especies de frutales como naranja (Citrus sinensis), zapote
(Quararibea cordata), banano (Musa paradisiaca), aguacate (Persea
americana) y mamey (Mammea americana), especies maderables como
guachapelí (Albizia guachapele), caña guadua (Indian thorny bamboo)
y palo prieto (Erythrina glauca); mientras que, en la finca II y III las
especies asociadas al cultivo de cacao se encontraban naranja (Citrus
sinensis), limón (Citrus limon), banano (Musa paradisiaca) y
palo prieto (Erythrina glauca).
Prieto-Benavides et al. (2012) observaron altas
concentraciones de esporas en suelos provenientes de cultivos de cacao
asociados a cultivos de especies frutales y maderables, por lo que manifiestan
que la diversidad y cantidad de esporas se encuentra relacionado a la biodiversidad
de especies vegetales; en este contexto, Meza et al. (2017) observaron
mayores concentraciones de esporas por gramo de suelo en plantaciones de melina
(Gmelina arborea) asociadas a un sistema agroforestal. Por lo tanto, las
concentraciones de esporas de HMA en zonas con diversidad de especies vegetales
pueden incluso considerarse como indicadores de deficiencia o valores altos de
las propiedades físicas y químicas del suelo (Sousa et al., 2018).

Figura 2. Concentraciones de esporas por finca
según su rango de edad; valores promedios de cinco replicas; letras distintas
sobre las barras indican diferencias estadísticas significativas según test de
Tukey (p<0,05); ± error experimental.
3.3 Porcentajes de micorrización
El mayor porcentaje de
micorrización se observó en la finca I para las plantas de cacao con edad entre
1-10 y 11-20 años, presentando valores de 80,3 y 79,3% respectivamente, como se
observa en la Figura 3-4, encontrando diferencia estadística
significativa entre las fincas en estudio. Por otra parte, la finca IV en
plantas con edad de 1-10 y 11-20 años presentaron menor porcentaje de
micorrización de 26,0 y 48,7% respectivamente. El elevado porcentaje de micorrización
de la finca I no se ve afectada por la edad de las plantas; dado que, se
obtuvieron cercanos porcentajes de micorrización; además que, ambas
plantaciones mantenían su agroecosistema de especies vegetales
(Prieto-Benavides et al., 2012); en este contexto, Meza et al. (2017)
obtuvieron altos porcentaje de micorrización en plantas de Gmelina arborea
en edad de 1 año; sin embargo, al realizar un evaluación a los 3 años
observaron que el porcentaje disminuyó, atribuyéndole esta reducción a la
pérdida de las especies vegetales que se encontraban en el primer año del
establecimiento de la plantación.
Lara-Pérez et al. (2014) indican que un suelo
proveniente de ecosistemas tropicales, la población e infección micorrízica es
mayor, por tal manera, se presume que la alta micorrización en la finca I se
presenta por el agroecosistema forestal en el que se encuentran las plantas de
cacao.
La baja micorrización en la finca IV posiblemente se
produce por la reiterada fertilización con alto contenido de fósforo; dado que,
las HMA no realizan su efectiva simbiosis con las plantas, repercutiendo en una
baja reproducción y colonización micorrización (Ova et al., 2015; Frater
et al., 2017; Mai et al., 2018), además, otro factor que se
relaciona a la baja micorrización es la aplicación de fungicidas, así lo
reportan Wang et al. (2018) al observar que aplicando Benomil en pruebas
de campo y laboratorio, disminuyó la micorrización y concentraciones de
esporas.
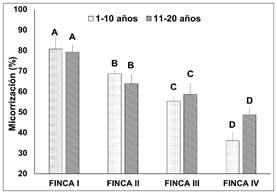
Figura 3. Micorrización de las fincas según su
rango de edad; valores promedios de cinco réplicas; letras distintas sobre las
barras indican diferencias estadísticas significativas según test de Tukey
(p<0.05); ± error experimental.
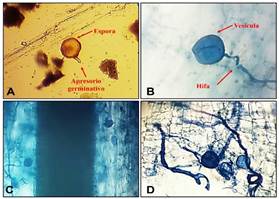
Figura 4. Estructura de los hongos micorrízicos
arbusculares (HMA) observadas con el campo de 40x. A: Espora con una parte de
su hifa de sustentación o apresorio germinativo; B-C-D: Vesículas e hifas.
3.4 Parámetros físicos-químicos del suelo en
la concentración de espora y micorrización
El suelo de las fincas en el análisis físico de suelo,
demuestran que las cuatro fincas poseen una textura franco limoso, ideales para
el desarrollo del cultivo de cacao, además, son propicios para otorgar una
mayor colonización y esporulación de las micorrizas arbusculares (Lacatela et
al., 2017). El pH del suelo de las cuatro fincas en estudio, se encontraban
entre rangos de 5,4 a 5,8 (medianamente ácido); por lo que, se puede mencionar
que el pH del suelo no influyó en las concentraciones de esporas y
micorrización de las fincas; dado que, se encontraban en rangos cercanos (Figura
5-6); no obstante, en otros estudios con HMA se ha demostrado que poseen la
capacidad de tolerar un bajo y alto pH, según el género de micorriza
(Carrino-Kyker et al., 2017; Wang et al., 2017); en este
contexto, Rojas-Mego et al. (2014) encontraron mayor abundancia de
esporas en fincas de cacao bajo sistema de cobertura utilizando Pueraria
phaseoloides con un suelo de 4,6 de pH con una textura franco.
La conductividad eléctrica (C.E.) en las cuatro
fincas, demuestran que no son suelos salinos por lo que se encuentran en
valores entre 0.35 y 0.96 dS/m (Figura 5-6); sin embargo, el mayor valor
de C.E. se presentó en la finca I; mientras que, la finca IV presento el menor
valor, por lo tanto, es importante mencionar que la C.E. y el pH en este
trabajo no fueron factores que influyeron en las concentraciones de esporas y
micorrización; dado que, en otros trabajos se ha demostrado que en plantas de
arroz inoculadas con micorrizas sometidas a estrés salino, otorgan que las
plantas produzcan una mayor producción fotoquímica para la fijación del CO2,
optimizando el uso de la energía solar en sus procesos fotosintéticos,
aumentando así la tolerancia a la salinidad de la planta. Por otro lado, en los
tejidos vegetales aéreos, los HMA intervienen en la extrusión de Na+ del
citoplasma, secuestrándolo en la vacuola (Estrada et al., 2013; Porcel et
al., 2016; Ruiz-Lozano et al., 2018).
La finca I y II presentaron una mayor micorrización y
concentración de esporas en los rangos de edad de 1-10 y 11-20 años, por lo que
se presume que el alto contenido de materia orgánica (M.O.) de 5,5 y 5,1 %
respectivamente (Figura 5-6) favoreció la colonización micorrízica. Por
otra parte, es importante mencionar que alto contenido de M.O. en el suelo está
relacionado a la presencia de las otras especies asociadas a la finca; dado
que, al producirse el desprendimiento de las hojas se acumulan en el suelo produciendo
un efecto de acondicionamiento para el desarrollo de los macro y
microorganismos benéficos, así otorgando un mejor desarrollo de las plantas
(Rojas-Mego et al., 2014; Verzeaux et al., 2017).
Las cuatro fincas presentaron un
nivel óptimo de fósforo que oscila entre los 62 y 75 ppm; sin embargo, este
factor químico del suelo al parecer no fue un factor limitante en la producción
de esporas y la colonización de las raíces de las plantas de cacao, pues a
medida que el nivel de fósforo aumenta, estos parámetros no se ven afectados,
además la finca I presentó una mayor micorrización y concentración de esporas
aunque existiera una mayor cantidad de fósforo de 75 ppm; mientras que la finca
IV su concentración de fósforo reportada se encontró en 62 ppm (Figura 5).
La mejor micorrización se presentó en la finca I en los rangos de edad 1-10 y
11-20 años en donde presentaron 80,3 y 79,3 % respectivamente, además que su
contenido de fósforo en el suelo se encuentra en 75 ppm, por lo que se concreta
que la micorrización en cacao en presencia de 75 ppm de fosforo no es un factor
limitante para el desarrollo e infección de los HMA; en este contexto, Bañuelos
et al. (2017) observaron en plantas de Persea Americana que la
colonización micorrízica disminuye a partir de una concentración de 80 ppm;
mientras que, a concentraciones de 20 ppm la micorrización fue de 78.3 %.
La finca IV proviene de un manejo
convencional o químico, por lo que se especula que la baja esporulación y
colonización de los HMA, se debe a la aplicación de fungicidas para el control
de enfermedades de cacao; por ende, es menor la población de estos microorganismos,
en cambio, en las otras fincas ocurre lo contrario por lo que la aplicación de
fungicidas no se considera para el control de enfermedades, además el contenido
de fósforo, pH, conductividad eléctrica y materia orgánica del suelo de las cuatro
fincas se encuentra en valores cercanos por lo que se difiere plenamente que el
contenido de esporas y micorrización es causada por la aplicación de los
fungicidas. En este contexto, Atens SL (2016), nos muestra una tabla con
ingredientes activos que afectan el normal desarrollo de las micorrizas, entre
los que se encuentra Propiconazole, Fosetil de aluminio y Mancozeb, que suelen
ser usados por los agricultores cacaoteros para control de hongos, disminuyendo
así, la micorrización y concentraciones de esporas de HMA. Así mismo, Henning et
al. (2018) comprobaron que la aplicación de fuentes de fertilizantes a base
de nitrógeno más la aplicación fungicidas durante 4 años redujeron la riqueza
de HMA, cambiando los patrones de esporulación e incluso redujeron la
diversidad y la productividad en las comunidades vegetales.
En otras investigaciones se
comprobó que el manejo de un suelo con labranza convencional la concentración
de esporas disminuye, en comparación a un suelo de labranza cero que la
población es mayor de los HMA (Bainard et al., 2017; Souza et al.,
2017). La ausencia de especies asociadas al cultivo de cacao en la finca IV
posiblemente sería otra causa para la baja esporulación y micorrización (Meza et
al., 2017; Sousa et al., 2018).
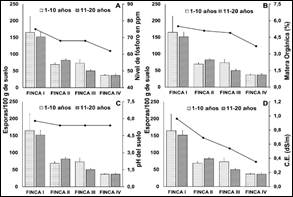
Figura 5. Concentraciones de esporas por finca
según su rango de edad y su relación con factores químicos del suelo. A:
Contenido de fósforo; B: Materia orgánica; C: pH del suelo; D: Conductividad
eléctrica. Valores promedios de cinco replicas; ± error experimental.
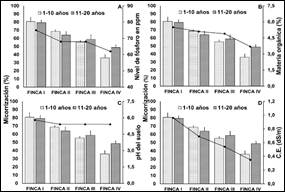
Figura 6. Micorrización por finca según su rango de
edad y relación con factores químicos del suelo. A: Contenido de fósforo; B:
Materia orgánica; C: pH del suelo; D: Conductividad eléctrica. Valores
promedios de cinco replicas; ± error experimental.
Conclusiones
La edad de una plantación de cacao (Theobroma cacao
L.) no es un factor limitante en la micorrización y contenido de esporas de las
micorrizas arbusculares, además los factores físicos y químicos del suelo son
óptimos para el desarrollo de las especies reportadas en este estudio de
micorrizas Acaulospora bireticulata, Acaulospora excavata, Claroideoglomus
lamellosum, Funneliformis coronatum, Funneliformis geosporum
y Pacispora boliviana; no obstante, el manejo convencional o químico de
las plantaciones de cacao al parecer es un limitante en el desarrollo de los
HMA en la esporulación y micorrización en comparación a las fincas orgánicas;
sin embargo, es indispensable destacar que el acompañamiento de especies
forestales y cultivos de frutales asociadas al cultivo de cacao de manejo
orgánico intervienen en la presencia de las micorrizas arbusculares.
Conflicto de intereses
Los autores declaran que no existe conflicto de
interés.
Contribución de los autores
Elías Villasagua participó en la recolección de los datos
de cada variable y en la revisión bibliográfica. Milton Barcos Arias y Andy
Mora González participaron en el diseño de la investigación, análisis e
interpretación de los datos, preparación y edición del manuscrito. Angela María
Reyes Laínez, Luis Damiani Sánchez Campoverde participaron en la revisión del
contenido del manuscrito.
Referencias
Agele, S., Aiyelari, P., Famuwagun,
B., Adegboye, J. y Oyeneyin, E. 2018. Effects of Watering Regime and Mycorrhizal Inoculation
on Seedling Growth and Drought Tolerant Traits of Cocoa (Theobroma cacao
L.) Varieties. International Journal of Horticulture. 8(13):147-162. Doi:10.5376/ijh.2018.08.0013
Albornoz, F. E., K.
W. Dixon y H. Lambers. 2021. Revisiting mycorrhizal dogmas: Are
mycorrhizas really functioning as they are widely believed to do? Soil Ecology Letters 3(1): 73- 82. Doi: https://doi.org/10.1007/s42832-020-0070-2
Álvarez-Manjarrez, J., A. U.
Solís Rodríguez, J. L. Villarruel-Ordaz, M. del P. Ortega-Larrocea y R.
Garibay-Orijel. 2021. Micorrizas del bosque tropical caducifolio y otras
simbiósis fúngicas. Acta Botánica Mexicana 128: e1906. Doi:
https://doi.org/10.21829/abm128.2021.1906
ANECACAO. 2024. Asociación Nacional
de Exportadores de Cacao e Industrializados del Ecuador. Obtenido de Edición
No. 27: [en línea] disponible en: http://www.anecacao.com
Aragão, C., Alves, G., Magna, D.,
Souza, J., Carenna, A., Carneiro, M., Oehl, F. 2013. Paraglomus pernambucanum sp. nov. and Paraglomus
bolivianum comb. nov., and biogeographic distribution of Paraglomus
and Pacispora. Journal of Applied Botany and Food Quality.
86(1):113-125. Doi:10.5073/JABFQ.2013.086.016
Atens SL. 2016. Agrotecnologías Naturales. Obtenido
de: Tabla de compatibilidades entre micorrizas y pesticidas: [en línea]
disponible en: https://www.atens.com/es/
Bainard, L., Chagnon, P.,
Cade-Menun, B., Lamb, E., LaForge, K., Schellenberg, M. y Hamel, C. 2017. Plant
communities and soil properties mediate agricultural land use impacts on
arbuscular mycorrhizal fungi in the Mixed Prairie ecoregion of the North American
Great Plains. Agriculture. Ecosystems and Environment. 249(1):187-195. Doi: https://doi.org/10.1016/j.agee.2017.08.010
Bañuelos, J., Sangabriel, C., Gavito,
M., Trejo, D., Camara, S., Medel, R. y Cerreon, Y. 2017. Efecto de diferentes niveles de
fósforo en aguacate (Persea americana) inoculado con hongos micorrízicos
arbusculares. Revista Mexicana de Ciencias Agrícolas. 8(7):1509-1520. Doi: https://doi.org/10.29312/remexca.v8i7.507
Bertolini, V., Montaño, N.,
Sanchez, E., Fregoso, L., Ruiz, J. y Martínez, J. 2018. Abundancia y riqueza de
hongos micorrizógena arbusculares en cafetales de Soconusco, Chiapas, México. Biología Tropical.
66(1):91-105.
Busayo, J., Jing, Li.,
Claire, E., Yong, Z., Yong-Long, W, Hui-Yun, G., Xing-Chun, L., Cong, W.,
Catharine, A., Cheng, G, Liang-Dong, G. 2022. Nitrogen fertilisation disrupts
the temporal dynamics of arbuscular mycorrhizal fungal hyphae but not spore
density and community composition in a wheat field¨. Doi:
https://doi.org/10.1111/nph.18043
Cardoso, E., Nogueira, M. A.
y Zangaro, W. 2017. Importance of Mycorrhizae in Tropical Soils. En J. Azevedo, & M.
Quecine (Edits.), Diversity and Benefits of Microorganisms from the Tropics
(págs. 245-267).
Springer, Cham. Doi: https://doi.org/10.1007/978-3-319-55804-2_11
Carranza,
Q., Angulo, M, Cedeño, G., Prado, Y. 2020. “Evaluación socioeconómica del
cultivo de cacao (Theobroma cacao L.) en la zona norte de la Provincia
de los Ríos”. Doi: https://doi.org/10.37956/jbes.v4i2.79
Carrillo-Saucedo, S., Puente-Rivera,
J., Montes-Recinas, S., & Cruz-Ortega, R. 2022. Las micorrizas como una
herramienta para la restauración ecológica. Acta Botánica Mexicana, (129),
e1932. Doi:
https://doi.org/10.21829/abm129.2022.1932
Carrino-Kyker, S., Kluber,
L., Coyle, K. y Burke, D. 2017. Detection of phosphate transporter genes from
arbuscular mycorrhizal fungi in mature tree roots under experimental soil pH
manipulation. Simbiosis.
72(2):123-133. Doi:10.1007/s13199-016-0448-1
Cuadros, G. A., Gómez, R. y
Rodríguez, N. F. 2011. Asociación simbiótica entre hongos micorrízicos
arbusculares y el sistema radicular de plántulas de cacao (Theobroma cacao
L.): efecto de la formononetina y la disponibilidad de fósforo en el suelo.
Corpoica Ciencia y Tecnología Agropecuaria. 12(1):77-85.
Estrada, B., Aroca, R.,
Maathuis, F., Barea, J. y Ruiz-Lozano, J. 2013. Arbuscular mycorrhizal fungi native
from a mediterranean saline area enhance maize tolerance to salinity through
improved ion homeostasis. Plant, Cell & Environment. 36(10):1771-1782. Doi:
https://doi.org/10.1111/pce.12082
Frater, P., Borer, E.,
Fay, P., Jin, V., Knaeble, B., Seabloom, E., Harpole, W. 2017. Nutrients and
environment influence arbuscular mycorrhizal colonization both independently
and interactively in Schizachyrium scoparium. Plant and Soil. 425(2):493-506. Doi: https://doi.org/10.1007/s11104-018-3597-6
García-Briones, Ana R., Pico-Pico,
Bryan F., & Jaimez, Ramón. 2021. La cadena de producción del cacao en
Ecuador: Resiliencia en los diferentes actores de la producción. Revista
Digital Novasinergia, 4(2), 152-172. Doi: https://doi.org/10.37135/ns.01.08.10
Gerdemann, J. y Nicolson, T. 1963. Spores of mycorrhizal
Endogone species extracted from soil by wet sieving and decanting, transactions
of the British. Mycological
Society. 46:235-244. Doi: S0007-1536(63)80079-0.
Goto, B., Moreira, M., Mui, S.,
Nogueira, E. y Costa, L. 2008. Notas sobre Acaulospora bireticulata
Rothwell & Trappe e primeiro registro de Acaulospora koskei Blask para o
Brasil. Acta Botanica
Brasilica. 22(2):583-587. Doi: https://dx.doi.org/10.1590/S0102-33062008000200025
Henning, J., Weiher, E., Lee, T.,
Freund, D., Stefanski, A. y Bentivenga, S. 2018. Mycorrhizal fungal spore community
structure in a manipulated prairie. Journal of the Society for Ecological
Restoration. 26(1):124-133. Doi: https://doi.org/10.1111/rec.12548
INVAM. 2017. International
Culture Collection of (Vesicular) Arbuscular Mycorrhizal Fungi: [en línea]
disponible en:
http://fungi.invam.wvu.edu/thefungi/classification/claroideoglomeraceae/claroideoglomus/lamellosum.html
Jean-Martial, J., Pascal, H.,
Abaubacry, K., Kadidia, B. y Neyra, M. 2013. Diversity patterns of indigenous
arbuscular mycorrhizal fungi associated with rhizosphere of cowpea (Vigna
unguiculata L. Walp.) in Benin, West Africa. Pedobiologia-International Journal
of Soil Biology. 56(3):121-128. Doi: https://doi.org/10.1016/j.pedobi.2013.03.003
Kormanik, P., Bryan, W. y
Schults, R. 1979. Endomycorrhizal inoculation during transplanting improves
growth of vegetatively propagated yellow poplar. Plant Propagator. 23(1):4-5.
Lacatela, W., Colina, E.,
Castro, C., Santana, D., León, J., García, G., Vera, M. 2017. Efectos De La
Fertilización Nitrogenada Y Fosfatada Sobre Poblaciones De Micorrizas Asociadas
Al Cultivo de Cacao. European Scientific Journal. 13(6):464-479. Doi:10.19044/esj.2017.v13n6p464
Lara-Pérez, L.,
Noa-Carrazana, J., Landa, Á., Hernández-Gonzalez, S., Oros-Ortega, I. y
Andrade, A. 2014. Colonización y estructura de la comunidad de hongos
micorrízicos arbusculares en Alsophila firma (Cyatheaceae) en bosque
mesófilo de montaña en Veracruz, México. Revista de Biología Tropical.
62(4):1609-1623.
Mai, W., Xue, X., Feng, G., Yang, R.
y Tian, C. 2018. Can optimization of phosphorus input lead to high productivity and high
phosphorus use efficiency of cotton through maximization of root/mycorrhizal
efficiency in phosphorus acquisition. Field Crops Research. 216:100-108.
Doi: https://doi.org/10.1016/j.fcr.2017.11.017
McGonigle, T., Miller, M.,
Evans, D. y Fai. 1990. A new method which gives an objective measure of
colonization of roots by vesicular—arbuscular mycorrhizal fungi. New Phytologist. 115(3),
495-501.
Meza, F., Díaz, E., Escobar,
T., Belezaca, C., Cachipuendo, J., Meza, G., Cabrera, R. 2017. Identificación
de Hongos Micorrízicos en Plantaciones de Melina (Gmelina arborea Roxb)
en el Trópico Húmedo Ecuatoriano. Revista de investigaciones veterinarias del
Perú. 28(4):969-975. Doi:http://dx.doi.org/10.15381/rivep.v28i4.13883
Moína-Quimí, E.,
Oviedo-Anchundia, R., Nieto-Barciona, S., Herrera-Samaniego, P., y
Barcos-Arias, M. 2018. Evaluación de los Hongos Micorrízicos Arbusculares de
zonas del trópico húmedo del Ecuador. Bionatura. 3(1):1-13. Doi: http://dx.doi.org/10.21931/RB/2018.03.01.9
Naranjo, J., Mora, A., Moina, E.,
Ruíz, O., Alvarado, O., Calle, P., Flores, J., Oviedo, J y Barcos-Arias, M. 2022.
Comportamiento en la absorción de Na y pb en plantas de cucurbitáceas e
inoculación de micorrizas arbusculares nativas en especie tolerante y
susceptible. Rev. Int. Contam. Ambie. 38, 587-601.
https://doi.org/10.20937/RICA.54023
Oehl, F. y Sieverding, E. 2004. Pacispora, un nuevo género de hongos
micorrízicos arbusculares vesiculares en Glomeromycetes. Journal of Applied Botany.
78:78-82.
Ova, E., Kutman, U.,
Ozturk, L. y Cakmak, L. 2015. High phosphorus supply reduced zinc concentration
of wheat in native soil but not in autoclaved soil or nutrient solution. Plant
and Soil. 393(2):147-162. Doi: https://doi.org/10.1007/s11104-015-2483-8
Pacheco, A., Naranjo, J.,
Reyes, G., Oviedo, J., Ratti, M., Barcos, M. 2022. Discovering the Diversity of
Arbuscular Mycorrhizal Fungi Associated with Two Cultivation Practices of Theobroma
cacao. Diversity.
14, 651. https://doi.org/10.3390/d14080651
Paredes-Andrade, N.,
Monteros-Altamirano, A., Paredes-Tapia A., Caicedo-Vargas, C., Lima Tandazo, L.
2021. Restauración de áreas agrícolas degradadas a través de sistemas
agroforestales de cacao en Amazonía Ecuatoriana. Doi 10.35381/cm.v7i1.486
Paredes, N.;
Monteros-Altamirano, Á.; Lima, L.; Caicedo, C.; Bastidas, S.; Tinoco, L.;
Fernández, F.; Vargas, Y.; Pico, J.; Subía, C.; Burbano, A.; Chanaluiza, A.;
Sotomayor, D.; Díaz, A.; Intriago, J.; Chancosa, C.; Andrade, A.; Enríquez, G.
2022. Manual del cultivo de cacao sostenible para la Amazonía ecuatoriana. 1era
Ed. Manual Nro. 125.
Pereira, C., Goto, B., Da
Silva, D., Ferreira, A., De Souza, F., Da Silva, G. y Oehl, F. 2015. Acaulospora reducta sp. nov. and A.
excavata two glomeromycotan fungi with pitted spores from Brazil. Mycotaxon.
130(1):983-995. Doi: http://dx.doi.org/10.5248/130.983
Pérez-Luna, Y.,
Alvarez-Solís, D., Hernández, L. y Sánchez-Roque, Y. 2016. Acaulospora excavata (Glomeromycota) in agricultural soils
of Chiapas, México. International Journal of Advance Agricultural Research. 4(2):6-9.
Phillips, J. y Hayman, D.
(1970). Improved procedures for clearing roots and staining parasitic and
vesicular-arbuscular mycorrhizal fungi for rapid assessment of infection.
Transactions of the British Mycological Society. 55:158-161.
Porcel, R., Aroca, R.,
Azcon, R. y Ruiz-Lozano, J. 2016. Regulation of cation transporter genes by the
arbuscular mycorrhizal symbiosis in rice plants subjected to salinity suggests
improved salt tolerance due to reduced Na+ root-to-shoot
distribution. Mycorrhiza, 26(7):673-684. Doi: https://doi.org/10.1007/s00572-016-0704-5
Prieto-Benavides, O.,
Belezaca-Pinargote, C., Mora-Silva, W., Garcés-Fiallos, F., Sabando-Ávila, F. y
Cedeño-Loja, P. 2012. Identificación de hongos micorrízicos arbusculares en
sistemas agroforestales con cacao en el trópico húmedo ecuatoriano. Agronomía
Mesoamericana. 23(2):233-239.
Rojas-Mego, K., Elizarbe-Melgar, C.,
Gárate-Díaz, M., Ayala-Montejo, M., Ruiz-Cubillas, P. y Sieverding, E. 2014. Hongos de micorriza
arbuscular en tres agroecosistemas de cacao (Theobroma cacao L.) en la
Amazonía Peruana. Folia Amazónica. 23(2):149-156. Doi: https://doi.org/10.24841/fa.v23i2.20
Ruiz-Lozano, J. M., Porcel,
R., Calvo-Polanco, M. y Aroca, R. 2018. Improvement of Salt Tolerance in Rice
Plants by Arbuscular Mycorrhizal Symbiosis. Root Biology. 52, 259-279. Doi: https://doi.org/10.1007/978-3-319-75910-4_10
Runzhi, Z, Yao, M., Xinrui,
L., Shumin, L., Ping, S., Xuerong, W., Haolei, W., Ning, Xu. 2020. Response of
the arbuscular mycorrhizal fungi diversity and community in maize and soybean
rhizosphere soil and roots to intercropping systems with different nitrogen
application rates. Science of The Total Environment, Volume 740. https://doi.org/10.1016/j.scitotenv.2020.139810
Sanchez-Lizarraga, A.,
Dendooven, L., Marino-Marmolejo, E., Davila-Vazquez, G., Hermández-Cuevas, L.,
Arena-Montaño, V. y Contreras-Ramos, M. 2017. Presence and diversity of arbuscular
mycorrhizal fungi in soil regularly irrigated with vinasses. Journal of Soil
Science and Plant Nutrition. 17(4):1116-1129. Doi: http://dx.doi.org/10.4067/S0718-95162017000400020
Sánchez-Roque, Y.,
Pérez-Luna, Y., Becerra-Lucio, A., Alvarez-Gutiérrez, P., Pérez-Luna, E.,
González-Mendoza, D. y Berrones-Hernández,
R. 2016. Effect
of arbuscular mycorrhizal fungi in the development of cultivars of Chili.
International Journal of Advance Agricultural Research. 4(2):10-15.
Sharma, S., Prasad, R.,
Varma, A. y Kumar, A. 2017. Glycoprotein Associated with Funneliformis
coronatum, Gigaspora margarita and Acaulospora scrobiculata
Suppress the Plant Pathogens In vitro. Asian Journal of Plant Pathology.
11(4):199-202. Doi:10.3923/ajppaj.2017.199.202
Sousa, N., Veresoglou, S.,
Oehl, F., Rillig, M. y Maia, L. 2018. Predictors of Arbuscular Mycorrhizal
Fungal Communities in the Brazilian Tropical Dry Forest. Microbial Ecology. 75(2):447-458.
Doi: https://doi.org/10.1007/s00248-017-1042-7
Souza, J., Oehl, F., Donizete, C.,
Torres, C., Coyne, D., Alves, D. y Costa, L. 2017. Diversity of arbuscular mycorrhizal
fungi in the Brazilian's Cerrado and in soybean under conservation and
conventional tillage. Applied Soil Ecology. 117:178-189. Doi: https://doi.org/10.1016/j.apsoil.2017.04.023
Tomio, B., Moreira, M.,
Mui, S., Jurandir, E., Nogueira, B. y Costa, L. 2008. Notas sobre Acaulospora
bireticulata Rothwell & Trappe e primeiro registro de Acaulospora
koskei Blask. para o Brasil. Acta Botanica Brasilica. 22(2):583-587. Doi: http://dx.doi.org/10.1590/S0102-33062008000200025
Utomo, B., Prawoto, A. A., Bonnet,
S., Bangviwat, A. y Gheewala, S. H. 2016. Environmental performance of cocoa
production from monoculture and agroforestry systems in Indonesia. Journal of
Cleaner Production. 134(6):583-591. Doi: https://doi.org/10.1016/j.jclepro.2015.08.102
Verzeaux, J., Hirel, B.,
Dubois, F., Lea, P. y Tétu, T. 2017. Agricultural practices to improve nitrogen use
efficiency through the use of arbuscular mycorrhizae: Basic and agronomic
aspects. Plant
Science. 264:48-56. Doi: https://doi.org/10.1016/j.plantsci.2017.08.004
Wang, N., Feng, Z., Zhou, Y.,
Honghui, Z. y Yao, Q. (2017). External hyphae of Rhizophagus irregularis DAOM 197198
are less sensitive to low pH than roots in arbuscular mycorrhizae: evidence
from axenic culture system. Environmental Microbiology Reports. 9(5):649-657. Doi:
https://doi.org/10.1111/1758-2229.12573
Wang, X., Wang, X., Sun,
Y., Cheng, Y., Liu, S., Chen, X., Kuyper, T. 2018. Arbuscular mycorrhizal fungi
negatively affect nitrogen acquisition and grain yield of maize in a N
deficient soil. Frontiers in Microbiology. 9(418). Doi: https://doi.org/10.3389/fmicb.2018.00418






