1. Introducción
La industria de polímeros se ha venido desarrollando desde hace algunas décadas. Con el avance de otras disciplinas como la nanotecnología y biotecnología; y con el interés mundial de reducir la contaminación industrial resultante de estos procesos, se ha visto un interés en la generación de biopolímeros empleando residuos agroindustriales como materia prima.
Los usos de los biopolímeros son variados, en el campo medico se usan como recubrimiento de fármacos; en el campo de alimentos se lo usa como contenedor de embutidos; siendo las industrias de la medicina y de alimentos las áreas más favorecidas que destaca con este desarrollo tecnológico, debido a las aplicaciones de biopolímeros en su estructura funcional. En el caso de los países en vías del desarrollo, como por ejemplo Ecuador, es un tema de poco conocimiento, ya que existe escasa investigación relacionada a las posibles materias primas que representen fuentes de obtención de membranas poliméricas.
En un porcentaje mayor, la obtención de polímeros se la realiza de origen sintético y en menor porcentaje de origen vegetal; pero, se están desarrollando algunos polímeros a partir de fuentes naturales, o a su vez naturales en combinación con los sintéticos.
Conforme se descubren nuevas materias primas para el desarrollo de membranas poliméricas es necesario caracterizar las películas para evaluar el efecto de la síntesis en las propiedades estructurales del material, propiedades que influyen de manera directa en el desempeño de las películas.
En la facultad de Ingeniería Química de la Universidad de Guayaquil se ha presentado una investigación de polímeros obtenidos de fuentes naturales, de origen animal, y a su vez combinaciones con polímeros de origen vegetal [1].
Otras investigaciones de origen bacteriano, usando la especie Gluconobacter xylinus, aislándola del hongo de té [2].
La obtención de celulosa bacteriana se ha vuelto de mucho interés en los últimos 6 años. Los estudios de biopolímeros de celulosa bacteriana se han enfocado en la síntesis de películas evaluando las fuentes o sustratos presentes en el medio de cultivo, las características relacionadas a la estructura y resistencia de la película; y su aplicación.
Se reporta en mayor parte de la literatura, que la aplicación de estos biopolímeros está orientada al área de alimentos y de salud.
Considerando que Ecuador es el único país que produce y exporta en grandes cantidades el cacao Colección Castro Naranjal (CCN51) y que producto de su procesamiento se generan residuos; estos residuos en su mayoría son utilizados para la generación de biocombustibles, o también se realizan licores. Se espera aprovechar dichos residuos aplicando la síntesis de celulosa bacteriana para la obtención de un biopolímero.
En el presente trabajo se plantea el uso de los excedentes industriales del cacao como una nueva materia prima para la producción de una membrana polimérica. Se espera que el producto generado pueda representar una fuente valiosa de material con propiedades estructurales que permita su posterior aplicación y a su vez que aquellos residuos de cacao CCN51 signifiquen una fuente atractiva para la generación del biopolímero.
Ecuador es uno de los países que tiene mayor producción de cacao a nivel mundial, por esta razón se han desarrollado varias investigaciones que contemplan el aprovechamiento de los excedentes de este fruto para generación de productos. A los excedentes se los ha utilizado como materia prima para estudios en diferentes campos, como alimenticio, farmacéutico, agrícola, entre otros; generando como productos: néctares, bebidas alcohólicas, cosméticos, herbicidas, entre otros [3]. Sin embargo, no existe investigación hasta la fecha donde se genere un material empleando este tipo de materia prima.
El exudado de cacao y la placenta contienen alto porcentaje de azúcares, los cuales son aprovechados en varias industrias, como por ejemplo la industria alimenticia aprovecha estos azúcares para la producción de licor, donde se da la fermentación y el licor pueda tener aroma y sabor característico del cacao [4].
Por otra instancia, entre los principales biopolímeros estudiados con el objetivo de crear materiales biodegradables, se encuentran: el polihidroxioctano (PHO), celulosa (CAB), Acido poliláctico, plastificación de almidón [5].
Existen estudios realizados sobre la producción de celulosa bacteriana sintetizada por bacterias que pertenecen a los géneros Acetobacter, con utilidad de oxidar azucares como la glucosa, sacarosa, fructosa entre otros; y etanol [6].
1.1. Cacao Colección Castro Naranjal (CCN-51)
Se menciona en ¨Manual del cultivo de cacao CCN-51¨, del Instituto Nacional de Investigaciones Agropecuarias (INIAP), que el cultivo de cacao CCN-51 pertenece a la especie Theobroma cacao, una de las más conocidas por su importancia en el campo económico y social en el país [7]. El clon CCN-51 es una planta de un tamaño mediano, que puede crecer hasta 20 metros; de hojas simples, enteras de color verde. Las flores de esta planta crecen en racimos pequeños y el fruto del cacao se le llama comúnmente mazorca. Esta última presenta una forma variable, pudiendo ser esférica a elíptica muy alargada y su coloración varía entre amarillo, naranja y morado. El peso del fruto se oscila entre 15g y 1kg, en el interior de la mazorca se encuentran un promedio de 50 almendras unidas de una columna llamada placenta, como se ilustra en la figura 1. La almendra de cacao o semilla es recubierta por una pulpa ácida azucarada llamada arilo o mucílago como se observa en la figura 2 [7].
El mucílago hidrolizado de cacao se conoce también en la industria como “exudado”. En el proceso de la fermentación nos provee el sustrato para algunos microorganismos los cuales son esenciales para el desarrollo de los precursores al sabor del chocolate, los cuales se expresan después en el proceso de tostado, además las pulpas frescas se las puede llevar a congelación y ser utilizadas como saborizante en otros campos principalmente el alimenticio para dar sabor a helados y yogures [8].
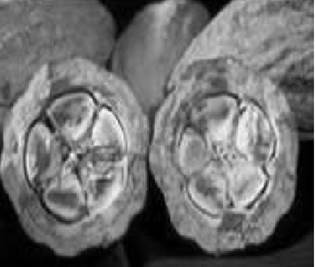
Fig. 1. Mazorca de Cacao
Fuente: [8]

Fig. 2. Mucílago o pulpa del cacao
Fuente: [8]
En el año 2017, destacó el Sistema de Información Pública Agropecuaria (SIPA) en su informe de producción de cacao que, durante ese año, en Ecuador hubo una producción total de 289102 toneladas de cacao tipo nacional y CCN-51, representando el 43% de la producción al primer semestre (Enero-Junio), y el 57% restante para el segundo semestre (Julio-Diciembre). En el informe se indica que la producción nacional de cacao fue 72% para la variedad CCN-51, mientras que para la variedad nacional fue 28%. El rendimiento ponderado fue de 0.65 t/ha en el cacao CCN-51 donde se destaca que anualmente cerca del 20% de la producción total son desperdicios, entre cáscara, granza, triturado, maguey, y que los desperdicios generados no tienen aplicación en ninguna actividad [9].
La Gluconacetobacter xylinus se encuentra en frutas, naturalmente, en estado de putrefacción. Es una bacteria aerobia estricta, con forma de varilla, que se la puede encontrar sola o agrupada en cadenas. Se puede observar el movimiento de algunas cepas durante la producción de celulosa debido a que algunas presentan flagelo, tiene un tamaño variable mayor a 2mm, como se muestra en la figura 3 [10].
Es utilizada, hasta el momento, para la producción de celulosa bacteriana utilizando como sustratos residuos de frutas; está presente en la mayoría de los casos en la interfaz aire-medio donde se puede constatar su presencia si es que esta produce una película de celulosa. De acuerdo con la investigación realizada por S. Masaoka, 1993 [11], su producción en condiciones óptimas es de 36 g/d m2, con un rendimiento de 100 %, utilizando como sustrato residuos agroindustriales de frutas tropicales.
Según Chávez. L. y col., 2004 [12], la película de la celulosa bacteriana posiciona a la bacteria en interfaz aire/liquido, facilitando la obtención de oxígeno necesario para su crecimiento. La celulosa bacteriana aparte de tener la función de mecanismo de flotación, para la bacteria sirve como protección para los rayos UV, teniendo la función de una barrera física. Permite a la bacteria aprovechar de mejor manera los sustratos en el medio, debido a que retiene la humedad exterior.
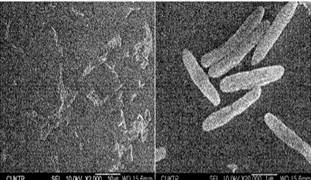
Fig. 3. Microfotografía de Gluconobacter xylinus
Fuente: [13]
La celulosa bacteriana (CB), también conocida como celulosa microbiana, es un polímero principalmente sintetizado por bacterias del género Acetobacter. En la naturaleza se encuentra la celulosa bacteriana como una protección para las colonias de microorganismos, que las protege de las diferentes condiciones ambientales. Esta membrana evita la deshidratación de los nitratos naturales, presentes en frutas en descomposición, la cual retiene humedad cerca de las células bacterianas y gracias a su poca transparencia a la luz ultravioleta da protección contra los efectos negativos de la radiación solar, de esta manera también previene la colonización de otros organismos como mohos y otras bacterias en el medio [14].
La CB fue descubierta por primera vez en 1886 por J. Brown, al observarse la formación de una película en las fermentaciones acéticas, cuando se aisló un microorganismo el cual fue cultivado en condiciones apropiadas, produciéndose una capa gelatinosa, traslucida sobre el líquido, donde por varios ensayos se identificó como una celulosa, ya que se formó la celulosa por la habilidad de la “planta del vinagre” y esta fue denominada bacteria xylinus que viene del griego Xýlinalína, que significa “tejido de madera” [14].
1.4. Características de la celulosa bacteriana
A pesar de que se puede obtener celulosa de origen vegetal, la CB es preferida ya que mantienen la misma estructura, más difieren en sus propiedades físicas. Se reportado que la CB independientemente de la materia prima usada mantiene una mayor pureza, mayor grado de polimerización, índice de cristalinidad, y cuenta con mayor resistencia a la tracción y una capacidad mayor de retención de agua, en relación con la celulosa vegetal (Ver tabla 1). Las fibras de CB son 10 veces más finas que la celulosa vegetal, por lo que el material es muy poroso [15].
Tabla 1.
Comparación de las diferentes características de la celulosa bacteriana y vegetal.
|
Característica |
Celulosa Bacteriana |
Celulosa Vegetal |
|
Dimensiones de las cadenas (mm) |
7.0-8.0 x10-5 1.33x10-4 1-1.17x10-4 |
Pino: 3.0-7.5x10-2 Abedul: 1.4-4.0x10-2
|
|
Grado de polimerización |
16000-20000 |
13000-14000 |
|
Módulo de young (Mpa) |
4.9 |
Algodón: 0.085 |
|
Densidad específica |
0.99 |
Algodón: 0.19 |
|
Temperatura de degradación (ºC) |
200-270 |
Algodón: 150 |
Fuente: [2]
1.5. Efectos de los componentes del medio y los factores de crecimiento de Gluconobacter xylinus.
La producción de celulosa y el crecimiento depende de la óptima combinación de varias fuentes de nutrientes incluyendo carbono, nitrógeno, sales minerales, las altas cantidades de celulosa bacteriana se producen por diferentes cepas en varios sustratos como glucosa, fructosa, manitol, sucrosa y glicerol [14]. La concentración inicial de las fuentes de carbono en la producción de celulosa tiene un efecto importante ya que debido a que la formación de ácido glucónico como un subproducto en el medio de cultivo va a disminuir el pH del cultivo y como última instancia va a disminuir la producción de celulosa. Existen estudios donde se estudia el rendimiento de celulosa con diferentes concentraciones iniciales de azúcares 6, 12, 24 y 48 g/L en los cuales el consumo fue de 100, 100, 68 y 28 % de la concentración al inicio, respectivamente [16].
1.6. Medios de cultivos utilizados
Hestrin y Schramm (HS) en el año 1954, crearon un medio de cultivo donde la composición era: peptona 0.5%, extracto de levadura (fuente de hidrogeno) 0.5 %, glucosa (fuente de carbono) 2%, fosfato disódico 0.27%, ácido cítrico 0.115% y valor de pH inicial de 6. Este cultivo se dio bajo las siguientes condiciones: a 30ºC en muestras de cultivo estático y agitado, en un tiempo de 2 a 5 días. Este tipo de cultivo ha sido usado como una referencia para poder determinar otros estudios debido a que se ha buscado aumentar los rendimientos y reducir los costos de la producción (Ver tabla 2). Se ha observado un mayor rendimiento en producciones de medios estáticos [17].
Rendimientos, métodos y condiciones de medios de producción estáticos para celulosa bacteriana.
|
Fuente de carbono |
Rendimiento (g/L) |
Técnica de producción en cultivo estático |
Microorganismo |
Referencia |
|
Medio HS |
10.12 |
t: 7 días T: 28ºC |
G. xylinus |
[18] |
|
Medio HS con 1% lignosulfonato |
16.32 |
t: 7 días T: 28ºC |
G. xylinus |
[18] |
|
Glucosa |
3.3 |
t: 15 días T: 28-30ºC |
Komagataeibacter medellinensis |
[19] |
|
Sacarosa |
3.3 |
t: 15 días T: 28-30ºC |
Komagataeibacter medellinensis |
[19] |
|
Fructosa |
0.38 |
t: 8 días T: 28-30ºC |
Komagataeibacter medellinensis |
[19] |
|
Fuente de nitrógeno de medio HS con jugo de naranja |
6.90 |
t: 14 días T: 30ºC |
Acetobacter xylinus |
[20] |
Sarango Y., 2017 [21], argumenta que los polímeros naturales, también conocidos como biopolímeros, son macromoléculas presentes sintetizadas por los seres vivos que se forman durante el ciclo de vida de los organismos.
Según Velde K. y Kiekens P., 2002 [22], los biopolímeros al igual que los polímeros, son macromoléculas formadas por la unión covalente de pequeñas unidades moleculares de pequeñas moléculas llamadas meros, que se obtuvieron mediante un proceso de polimerización a partir de moléculas más pequeñas denominadas monómeros.
Un biopolímero interactúa siempre con un sistema biológico. El biopolímero es una sustancia sólida tipo orgánico, o inerte. Se han investigado algunas posibles interacciones entre el biopolímero y el ser vivo. Dentro de la investigación de S. Stupp y P. Braun se describen algunas funciones de biopolímeros entre las que mencionan las de evaluar o corregir algún tejido, órgano o función del organismo [23].
El comité Europeo de Normalización [24], define que los biopolímeros son bioplásticos que tienen un origen basado en la biomasa por lo tanto es considerado renovable, estos pueden ser biodegradables. Se los encuentra de formación natural o sintética, o una combinación de las dos. Hay que tener en cuenta que los plásticos biodegradables no siempre tienen origen de la biomasa, y que los plásticos que de originan de la biomasa no siempre son biodegradables. De acuerdo con Tharanathan, 2003 [25], los biopolímeros naturales provienen de cuatro fuentes: origen animal como colágeno o gelatina, origen marino como la quitina y el quitosano, origen agrícola como lípidos y grasas e hidrocoloides: proteínas y polisacáridos y origen microbiano (ácido poliláctico (PLA) y polihidroxialcanoatos (PHA). Por sus altas tazas de biodegradabilidad y sus excelentes propiedades físico‐mecánicas los PHA y los PLA han resultado ser los de más amplia aplicación en la actualidad.
La gran mayoría de biopolímeros que se originan de recursos renovables, se vuelven importantes para la industria de los plásticos [26] [27], estos pueden tener el mismo proceso industrial que los plásticos convencionales, tales como soplado, inyección o extrusión [28].
El Centro Tecnológico Nacional de la Conserva y Alimentación, 2013 [29] , expone que los biopolímeros se asemejan con los polímeros obtenidos del petróleo, en lo que es sus propiedades fisicoquímicas y termoplásticas; con una sola importante diferencia, que una vez desechados los biopolímeros se biodegradan. Es de esta comparación, de donde se establecen las grandes ventajas de la sustitución del petróleo para la fabricación de polímeros, lo que reduciría de una manera notable la contaminación al medio ambiente.
Según Martínez T. y col., 2013 [30], los biopolímeros pueden tener una clasificación de dos tipos: los que provienen de seres vivos y otro que deben ser sintetizados, teniendo una procedencia de un recurso renovable.
Los biopolímeros según su fuente pueden clasificarse en tres subgrupos de acuerdo con el mercado: polímeros que tienen como fuente un recurso renovable (almidón y celulosa), polímeros biodegradables que se basan en la derivación de monómeros (aceites y ácido láctico) y biopolímeros de síntesis microbiana [31] [32].
La tecnología avanza de forma paralela con el desarrollo de nuevos biopolímeros. Los biopolímeros cumplen un papel importante en la composición de nuevos sistemas terapéuticos y a su vez en el empleo de la ingeniería de tejidos [33]. Esto hace permite ubicar a los biopolímeros en el campo médico y farmacéutico.
Los polímeros con características biodegradables que provenga de una fuente natural renovable y sean biodegradables pueden ser usados como recubrimientos y películas comestibles, como también en la fabricación de nano fibras para el desarrollo de alimentos funcionales. Esto permite ubicar a los biopolímeros en la industria alimentaria [34] [35].
1.8. Características de los biopolímeros
Los biopolímeros presentan características semejantes a los polímeros sintéticos, pero a diferencia de los sintéticos los biopolímeros provienen de una materia prima renovable y su producción es limpia. Los biopolímeros de origen bacteriano dependen de la enzima (sintasa) y de diversos sustratos que determinan si es un polímero de cadena corta o media. Dentro de sus características esta: ser termoplásticos, elásticos y flexibles dependiendo de su composición. La composición química de síntesis varía sus propiedades. Tienen estabilidad ante la radicación UV, baja permeabilidad al agua. Sus mecánicas como también su biocompatibilidad serán dependiente de la mezcla o la combinación con otros polímeros, y utilización de otras enzimas. Todo lo ante mencionado permite tener una amplia gama de aplicación de este material [36].
1.9. Aplicaciones de los biopolímeros
Los biopolímeros son el reemplazo de los polímeros sintéticos en varios usos, debido a su rápida degradación y a su nula contaminación. La biodegradabilidad de los biopolímeros ha permitido ubicarlos en la manufactura eco-amigable, haciéndolos competente como alternativa de productos no sustentables [37]. Los biopolímeros son usados como reemplazo de los empaques sintéticos para alimentos, pero representan un gasto un poco mayor [38]. En el uso biomédico los biopolímeros apuntan a el control de liberación de fármacos, como solución a el cambio del pH, permitiendo el transporte y diagnóstico del cáncer [39].
2. Materiales y métodos
La presente investigación tiene un nivel de carácter experimental debido a que se pone a prueba diferentes formulaciones con los residuos de cacao; y exploratorio porque se va a caracterizar el material y mencionar de una manera detallada sus propiedades, facilitando así la evaluación del rendimiento del material obtenido.
Para la obtención de este biopolímero se aisló la bacteria “Gluconobacter xylinus” del té de kombucha y se la activó en un medio H-S líquido modificado (Fuente de carbono; ausencia de ácido cítrico) con excedentes de cacao, lográndose la generación del pre-inóculo.
El medio H-S líquido, anteriormente mencionado, se utilizó para preparar el inóculo, el mismo que contiene 10 ml del pre-inóculo y los diferentes medios H-S modificados y formulados con las diferentes fuentes de carbono: cacao, sorbitol y glicerol. Estas formulaciones se realizaron en tres réplicas y se procedió con la fermentación de cada una de las muestras, generándose las membranas de celulosa bacteriana. Obtenidas las diferentes membranas se procede a lavarlas y a blanquearlas, para posteriormente realizar la evaluación de las características físicas y mecánicas de estas y a su vez determinar su rendimiento bajo un análisis ANOVA.
La investigación consiste en la producción de un biopolímero utilizando como materia prima los desechos agroindustriales del cacao CCN-51 y un aislado nativo de Gluconobacter xylinus. Se varió las fuentes de carbono del medio de producción, empleando excedentes de cacao, sorbitol y glicerol. Las variaciones se realizaron de manera que exista un 100 % de sacarosa propia de los residuos agroindustriales del cacao en la primera formulación; un 50% en la formulación 2 y 3, en combinación con otras fuentes de carbono, sorbitol y glicerol, respectivamente.
Formulaciones de fuentes de carbono en el medio de producción representada en porcentajes.
|
Fuentes de carbono |
Formulaciones |
||
|
1 |
2 |
3 |
|
|
Cacao |
100% |
50% |
50% |
|
Sorbitol |
0 |
50% |
0 |
|
Glicerol |
0 |
0 |
50% |
Finalizada la fermentación y una vez obtenido el producto; se evaluaron las muestras de celulosa bacteriana, por medio de análisis sensorial (color), humedad, dimensiones (diámetro y grosor) y se calcula su respectivo rendimiento. Adicionalmente, las muestras se sometieron a prueba mecánica de tracción y a pruebas físicas de SEM, DSC y FTIR, las cuales permitieron caracterizar de manera profunda el material obtenido.
Para evaluar las características de este biopolímero se realizaron los análisis de microscopía electrónica de barrido (SEM), en base a la norma ASTM E986; calorimetría diferencial de barrido (DSC); bajo normativa ISO 11357-3; tracción, bajo la normativa ASTM D882; humedad bajo la normativa GOST 16932-93; espectrofotometría infrarroja (FTIR) en referencia a la normativa ASTM E1252; color y el dimensionamiento de las películas.
Los resultados obtenidos fueron evaluados estadísticamente bajo un análisis de varianza ANOVA simple.
Fig. 4. Preparación de Té de Kombucha
2.2. Metodología de estimación rendimiento
Se calcularon los rendimientos en base al Volumen del medio de Producción (RVP) y al peso de la Fuente de Carbono (RFC), los cuales quedan expresados en g/lt y g/kg, respectivamente.
Para calcular dichos rendimientos se utilizó las masas de las membranas de celulosa obtenidas por triplicado y se calcularon los rendimientos, aplicando las fórmulas nombradas a continuación:
|
|
(1) |
|
|
(2) |
El rendimiento de la celulosa o biopolímero de los medios de cultivo se analizó mediante un gráfico de barras, donde se muestra la media de los rendimientos y su desviación estándar respectiva.
2.3. Metodología de análisis humedad
Para determinar el contenido de humedad que tienen estas membranas, se toma una muestra de 2g de producto en base húmeda y se la lleva a secado durante 3 horas, a una temperatura de 105 ± 3 ºC, posteriormente se deja enfriar en un desecador hasta alcanzar la temperatura ambiente. Este procedimiento se realizó de acuerdo con la normativa GOST 16932 - 93. Se aplicó la siguiente formula:
|
|
( 3) |
Donde:
![]()
![]()
2.4. Metodología de análisis tracción
La tracción fue evaluada a las diferentes membranas según la normativa ASTM D882, esta norma evalúa teniendo como principio fundamental el Módulo de Young, pero se la llevó a cabo con modificación. Se modificó las dimensiones de las membranas, pero trabajando en base al mismo principio. A esta membrana se la colocó sostenida de sus dos extremos, en su parte inferior contaba con un porta-masas al cual se le fue agregando peso hasta que esta se rompiera.
2.5. Metodología de análisis SEM
El ensayo de microscopia electrónica de barrido es realizado en el Laboratorio de Ensayos Metrológicos y de Materiales LEMAT-ESPOL; de acuerdo con la metodología basada en la normativa ASTM E986 “Standart Practice for Scanning Electron Microscope Beam Size Characterization”.
2.6. Metodología de análisis DSC
Este análisis se lo realizó en el Laboratorio de Ensayos Metrológicos y de Materiales LEMAT-ESPOL, se lo realizó bajo la normativa ISO 11357-3 y el equipo utilizado fue el Analizador Térmico SDT Q600, EM-004. Se lo realizó a dos muestras de diferentes formulaciones.
2.7. Metodología de análisis FTIR
Este análisis se lo llevó a cabo en el Laboratorio de Ensayos Metrológicos y de Materiales LEMAT-ESPOL, evaluado en base a la normativa ASTM E1252. El equipo donde se realizó el análisis de las muestras es el PerkinElmer Spectrum Versión 10.4.2.
Para los posteriores resultados de la gráfica de FTIR se deben considerar los grupos funcionales que se pretenden encontrar en celulosa. Estos grupos funcionales mantienen un rango valores de acuerdo con el espectro, como se muestra en la siguiente tabla.
Interpretación de espectros en FTIR.
|
Enlaces |
Tipo de vibración |
Rango de longitud de onda (cm-1) |
|
C-H
|
Alcano (tramo) |
3000 - 2850 |
|
-CH3 (curva) |
1450 and 1375 |
|
|
-CH2- (curva) |
1465 |
|
|
Alcano (tramo) (fuera de plano) |
3100 – 3000 1000 - 650 |
|
|
Aromáticos (tramo) (fuera de plano) |
3150 – 3050 900 - 600 |
|
|
Alquino (tramo) |
̴̴3300 |
|
|
Aldehido |
2900 – 2700 |
|
|
O-H |
Alcoholes, libres de fenoles |
3650 – 3600 |
|
Ácido carboxilico |
3400 – 2400 |
|
|
C≡C |
Alquino |
2250 – 2100 |
|
C-O |
Alcoholes, esteres, eteres, ácido carboxilico, anhidros |
1300 – 1000 |
Fuente: [40]
2.8. Metodología de balance de materia
Se realizó un balance de materia para determinar la cantidad total de materia prima obtenida, aplicando la operación de filtración, utilizando pesos promedios de las partes de interés (mucílago, placenta y lixiviado), entre 5 mazorcas de cacao CCN-51. Para la realización del balance de materia se emplearon la siguiente ecuación:
Balance de residuos
|
|
(4) |
Balance de medio de cultivos
|
|
(5) |
|
|
(6) |
|
|
(7) |
|
|
(8) |
3. Resultados
En la tabla 5 se muestra un resumen estadístico, en la cual se evalúan las variables para cada una de las formulaciones, en donde observamos los valores obtenidos de la media, la desviación estándar y coeficiente de variación.
Los resúmenes estadísticos exponen, que la desviación estándar de los datos obtenidos con respecto a su media, para cada una de las formulaciones, es alta en las variables RVP, RFC. Mientras que esta desviación es baja para humedad, y tracción. Así mismo, la relación que existe entre el tamaño de la media y la variabilidad de la variable (coeficientes de variación), se muestran altos para RVP, RFC y bajos para humedad y tracción, por lo que podemos asegurar que la producción y por lo tanto el RVP y el RFC pudieron verse afectados por efectos externos, como variaciones de temperaturas de fermentación (producto de la inestabilidad eléctrica en las instalaciones); factor que puede inhibir el crecimiento de Gluconobacter xylinus y a su vez su capacidad para la producción de celulosa bacteriana. Esto debido a la diferencia de las masas obtenidas en producción en cada formulación, como lo reporta Jaramillo et al, 2012. [41]. Por otro lado, para humedad y tracción los coeficientes de variación reportan una dispersión baja, por lo tanto, suponemos que las metodologías usadas para obtener los datos de las variables son confiables, como lo explica Castro, 2015 [42].
Datos estadísticos de las variables evaluadas
|
Estadística de RVP |
||||
|
Formulación |
Recuento |
Media |
Desviación Estándar |
Coeficiente de variación |
|
F1 |
3 |
5,90262 |
3,19657 |
54,1551% |
|
F2 |
3 |
10,4436 |
7,52525 |
72,0558% |
|
F3 |
3 |
0,277452 |
0,247674 |
89,2673% |
|
Total |
9 |
5,54124 |
6,0149 |
108,548% |
|
Estadística de RFC |
||||
|
Formulación |
Recuento |
Media |
Desviación Estándar |
Coeficiente de variación |
|
F1 |
3 |
12,8443 |
6,95586 |
54,1551% |
|
F2 |
3 |
21,2958 |
15,3449 |
72,0558% |
|
F3 |
3 |
0,578647 |
0,516543 |
89,2673% |
|
Total |
9 |
11,5729 |
12,3456 |
106,676% |
|
Estadística de Humedad |
||||
|
Formulación |
Recuento |
Media |
Desviación Estándar |
Coeficiente de variación |
|
F1 |
3 |
68,7833 |
2,58666 |
3,7606% |
|
F2 |
3 |
67,4667 |
3,72201 |
5,51681% |
|
F3 |
3 |
--- |
---- |
----- |
|
Total |
9 |
45,4167 |
34,1426 |
3,7606% |
|
Estadística de tracción |
||||
|
Formulación |
Recuento |
Media |
Desviación Estándar |
Coeficiente de variación |
|
F1 |
3 |
1200,0 |
264,575 |
22,0479% |
|
F2 |
3 |
1300,0 |
50,0 |
3,84615% |
|
F3 |
3 |
---- |
---- |
---- |
|
Total |
9 |
833,333 |
640,8 |
76,896% |
Los datos obtenidos fueron evaluados en un diagrama de caja y bigote, el cual es útil para poder realizar comparaciones gráficas entre las variables estudiadas. El análisis de los datos tabulados y los gráficos permiten aceptar la hipótesis nula, la que nos indica que no existe diferencia significativa entre las medias de las variables de cada formulación y sus respectivos rendimientos [42].
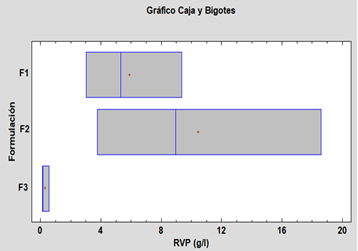
Fig. 5. Caja y bigotes para la variable RVP
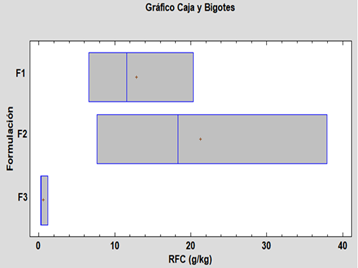
Fig. 6. Caja y bigotes para la variable RFC
No hay diferencias estadísticamente significativas entre medias, con un nivel del 95% de confianza; podemos decir que las variables de humedad y tracción no se ven influenciadas significativamente por las formulaciones, pero la F2 presenta mejor resultado.
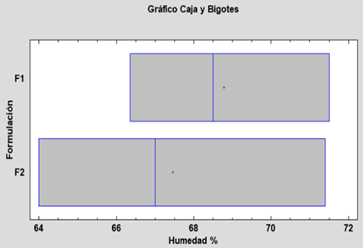
Fig. 7. Caja y bigotes para la variable humedad
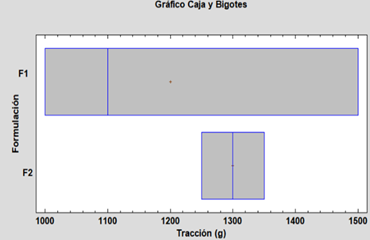
Fig. 8. Caja y bigotes para la variable tracción
El balance de MP se lo realizó para determinar la cantidad total de residuos líquidos necesarios, teniendo como resultado que se necesitan 2457 g de residuos líquidos.
En el balance de medio de cultivo se observa la cantidad de residuos líquidos que son necesarios para cada una de las formulaciones, dando como resultado que en F1 se requiere 409.5 g de residuos filtrados; para F2: 204.75 g de residuos filtrados y 204.75 g de sorbitol; para F3: 204.75 g de residuos filtrados y 204.75 g de glicerol.
4. Conclusiones
· Se aisló la bacteria Gluconobacter xylinus del té de kombucha y se demostró la presencia de dicha bacteria realizando la práctica de tinción de gram, donde se pudo verificar que tenían la misma morfología.
· Sé realizó la producción, y se pudo determinar las características físico-mecánicas de los biopolímeros obtenidos, a partir de las diferentes formulaciones expuestas.
· La metodología aplicada en el proceso fue óptima para obtener un biopolímero a partir de residuos agroindustriales de cacao CCN-51, es decir con una fermentación estática a 35C por 15 días, con su posterior lavada, blanqueado y secado.
· Mediante la metodología expuesta se pudo obtener un biopolímero aplicando tres formulaciones diferentes en relación con las fuentes de carbono, que incluye en F1 (excedentes de cacao); F2 (excedentes de cacao: sorbitol); y F3 (excedentes de cacao: glicerol), donde F2 obtuvo el mejor rendimiento por volumen de producción (10.43 g/lt) y por fuente de carbono (21.29 g/kg), al compararlas con sus fuentes alternativas.
· Se logró obtener como resultado que F2, que es la combinación de excedentes de cacao (55%) y sorbitol (45%), demuestra mayor resistencia a la fuerza, mayor rendimiento, mayor producción y temperatura de degradación, con relación a las otras formulaciones estudiadas. Las medias de estas variables fueron mayores a las otras formulaciones, más no mantienen diferencias significativas, comprobada mediante análisis estadístico.
· Mediante el análisis FTIR se pudo verificar que se obtuvo una celulosa, porque presenta los grupos funcionales característicos de una celulosa.
· Se verificó mediante el análisis SEM que la estructura de las membranas presentó características similares a la de una celulosa, al compararlas con su fuente alternativa.
· Se concluye que el cacao tipo CCN-51, es un residuo orgánico que puede ser aprovechado para la producción de una celulosa bacteriana (biopolímero)
Referencias.
|
[1] |
Bustamante R ; Peralta M, «Caracterización De Biopolímero Obtenido A Partir,» Universidad de Guayaquil, pp. 51- 62, 2018. |
|
[2] |
Carreño L.D. , «Efecto de las Condiciones de Cultivo y Purificación sobre las Propiedades Fisicoquímicas y de Transporte en Membranas de Celulosa Bacteriana,» Bogotá, Colombia , 2011. |
|
[3] |
Quimbita, F., Rodriguez, P., Vera, E., «Uso del exudado y placenta del cacao para la obtención de subproductos,» Departamento de Ciencia de Alimentos y Biotecnología, vol. 26, pp. 8-15, 2013. |
|
[4] |
Rodriguez P. Quimbita F., «Aprovechamiento del exudado y la placenta del cacao (Theobroma cacao) para la producción de una bebida alcohólica de baja concentración y elaboración de nectár.,» Quito, 2008. |
|
[5] |
Pillai, K., «Nanocompuestos de celulosa bioinspirados,» Virginia Polytechnic Institute and State University, Blacksbrug, Virginia, 2011. |
|
[6] |
Santos, S; Carbajo, J; & Villar, Juan., «Celulosa Bacteriana,» ResearchGate, 2015. |
|
[7] |
C. Suárez Capello, M. Moreira Duque y J. Vera Barahona, "Manual del Cultivo de Cacao N°25", Estación Expeimental Tropical Pichilingue: INIAP, 1994. |
|
[8] |
Arteaga Y., «Estudio del desperdicio del mucílago de cacao en el cantón Naranjal,» ECA. Sinergia, vol. 4, pp. 54-55, 2013. |
|
[9] |
SIPA, Ministerio de Agricultura y ganadería, 2015. |
|
[10] |
Gama M.G, Bacterial NanoCelullose: A Sophisticated Multifunctional Material, 2012. |
|
[11] |
S. Masaoka, T. Ohe y N. Sakota, «Production of cellulose from glucose by Acetobacter xylinum,» Journal of Fermentation and Bioengineering, vol. 75, pp. 18-22, 1993. |
|
[12] |
L. Chávez, M. S, M. Contreras y E. E., Celulosa bacteriana en Gluconacetobacter Xylinu; biosíntesis y aplicaciones, Mexico, 2004. |
|
[13] |
Jeonju, «Jeonju- Korea Patente nº WO2013073722». Korea Patente WO2013073722, 2013. |
|
[14] |
Dufresne, A. T, Biopolymer Nanocomposites processing, properties and applications, New Yersey: John Wiley & Sons, 2013. |
|
[15] |
Shoda, M. S., «Recent advances in bacterial cellulose production.,» Biotechnol, Bioprocess Eng, pp. 1-8, 2005. |
|
[16] |
Chawla P.B., «Microbial Cellulose: Fermentative Production and Applications,» Food Technol. Biotechnology, pp. 107-124, 2013. |
|
[17] |
Hestrin & Schramm, «Factors affecting production of cellulose at the air/liquid interface of a culture of Acetobacte xylinum,» J. gen. Microbiol, pp. 123-129, 1954. |
|
[18] |
Keshk, S & Sameshima, K., «Influence of lignosulfonate on crystal structure and productivity of bacterial cellulose in a static culture,» Enzyme and Microbial Technology , 2006. |
|
[19] |
Ramirez C, Castro M, Osorio M, Taborda M, Gomez B , «Effect of different carbon sources on bacterial nanocellulose production and structure using the low pH resistant strain Komagataibacter Medellinensis,» Materials (Basel) , 2017 . |
|
[20] |
Kurosumi A, Sasaki, Chizuru, Yamashita, Yuya & Nakaruma, Y., «Utilization of various fruit juices as carbon source for production of bacterial cellulose by Acetobacter xylinum,» Carbohudrate Polymers , pp. 333-335, 2009. |
|
[21] |
Y. Sarango, «Extracción y acracterización de un bipolímero natural a partir del cáliz de Physalis Peruviana L.,» Loja, 2017. |
|
[22] |
K. Velde y P. Kiekens, Polymer Testing, vol. 21, 2002, pp. 433-442. |
|
[23] |
S, Stupp; P, Braun, Role of Proteins in Microstructural Control:Biomaterials, Ceramics & Semiconductors,, vol. 277, Science, 1997, p. 1242. |
|
[24] |
I. J. Quiñones, «Vigilancia Tecnológica Aplicada para Identificar las Tendencias Tecnológicas en los Biopolímeros y Plásticos Biodegradables,» Revista Informador Técnico, p. 54, 2009. |
|
[25] |
Tharanathan, Biodegradable films and composite coatings: past, presente and future, vol. 14, 2003, pp. 71-78. |
|
[26] |
J. Philp, R. Ritchie y K. and Guy, «Biobased plastics in a bioeconomy,» Trends Biotechnol, vol. 31, pp. 65-67, 2013. |
|
[27] |
B. DiGregorio, «Biobased performance bioplastic:Mirel,» Chem Biol, pp. 1-2, 2009. |
|
[28] |
M. Valero, Y. Ortegon y Y. Uscategui, «Biopolimeros: Avances y Perspectiva,» pp. 172-173, 2013. |
|
[29] |
CTC-CSIC;Centro tecnologico nacional de la conserva y alimentacion, «Biopolimeros,» Agro Waste, p. 1, 2013. |
|
[30] |
C. R. Morin, Martinez-Tenorio y L. A.-M. Vigil, «Biopolimero y su integracion con polimeros convencionales como alternativa de empaque de alimentos,» Temas selectos de ingenieria de Alimentos, pp. 42-45, 2013. |
|
[31] |
L. Yu, K. Dean y L. li, «Polymer blends and composites from renewable resources, Progress in Polymer Science,» vol. 6, nº 31, pp. 576-602, 2006. |
|
[32] |
M. V. Uscategui y Y. O. Yomaira, «Biopolímeros: Avances Y Perspectivas,» Dyna, vol. 80, nº 181, pp. 171-180, 2013. |
|
[33] |
S. s. Mata y J. D. Y, «Expanding Fron-tiers in Biomaterials,» MRS Bulletin, vol. 30, pp. 864-873, 2005. |
|
[34] |
H. V. Velasco y H. A. Reinado, «Biopolímeros Naturales Usados En Empaques Biodegradables,» Temas Agrarios, vol. 12, nº 2, pp. 5-13, 2007. |
|
[35] |
Grupo de Investigación de Biopolímeros en Alimentos (GIBA) , «seminario internacional sobre Innovaciones y tendencias en la aplicación de biopolímeros,» de Innovaciones y tendencias en la aplicación de biopolímeros en la industria de alimentos en seminario, Chile, 2015. |
|
[36] |
García, L. A., Betancur, J. A. N., Ramírez, A. M. F., & Arboleda, L. M. H, « Estudio de la síntesis de biopolímeros de origen microbiano,» Revista QUID, nº 25, 2015. |
|
[37] |
Ospina, S, «Biopolímeros y su aplicación en medio ambiente,» Revista Colombiana de Biotecnología, vol. 17, nº 2, pp. 5-6, 2015. |
|
[38] |
Cruz-Morfin, R., Martínez-Tenorio, Y., & López-Malo, A., «Biopolímeros y su integración con polímeros convencionales como alternativa de empaque de alimentos,» Temas de Selección de Ingeniería de Alimentos, vol. 7, nº 2, pp. 42-52, 2013. |
|
[39] |
Neira-Carrillo, A., Muñoz, D. Y., Zazzali, P. A., Marini, Y. A., Vilches, S. V., & Palma, R. E, «Encapsulación de biomoléculas usando polímeros naturales:“un nuevo enfoque en la entrega de fármacos en medicina”,» Avances en Ciencias Veterinarias, vol. 28, nº 2, p. 31, 2013. |
|
[40] |
Villar A., «Caracterización de polímeros materiales.,» Agilent technologies, vol. 1, 2012. |
|
[41] |
P. Jaramillo Ruben L, I. Tobio Wladimir y P. Escamilla José, «Efecto de la sacarosa en la producción de celulosa por Gluconacetobacter xylinus en cultivo estático,» MVZ Córdoba, vol. 2, nº 17, pp. 3004-3013, 2012. |
|
[42] |
M. C. Riascos., «Determinación de las condiciones de cultivo para la producción de celulosa por la bacteria nativa Gluconacetobacter medellinensis,» Título de Magister en Biotecnología, pp. 40-45, 2015. |