1. Introducción
Internacionalmente, los entes reguladores de laboratorios clínicos varían de país en país. Sin embargo, organizaciones como el Instituto de Estándares clínico y de laboratorio (CLSI) y asociaciones como Asociación de Investigación de Calidad (RQA) existen para promover un enfoque más global a la regulación de laboratorios clínicos. [1]
Adicionalmente existen los estándares de buena práctica de laboratorio, originados en el 2002 y adoptados desde ese entonces por la OMS. Esto nos dice que se cuenta con organizaciones no gubernamentales e instituciones de investigación alrededor del mundo que proveen guías para la implementación de prácticas correctas que son esenciales para las operaciones realizadas por laboratorios alrededor del mundo.
La OMS se encarga de asesorar a los países en la creación o el acceso a servicios de laboratorio, sistemas de transporte de especímenes, gestión del riesgo biológico y sistemas de calidad de los laboratorios, para que puedan cumplir con los compromisos que han contraído en virtud del Reglamento Sanitario Internacional (RSI). [2]
El RSI es un instrumento jurídico internacional de carácter vinculante, en el que están involucrados 194 países, todos aquellos estados miembros de la OMS; cuyo objetivo es colaborar con la comunidad internacional para la prevención y afrontar riesgos agudos de salud pública que tienen la capacidad de atravesar fronteras y poner en riesgo a las poblaciones de todo el mundo. [3]
En Ecuador, contamos con el Servicio de Acreditación Ecuatoriano (SAE), el cual es el órgano oficial en materia de acreditación. La SAE es una entidad técnica de derecho público, que posee personería jurídica, autonomía en su administración, economía, finanzas y operaciones; y no tiene fines de lucro. Su sede es en la ciudad de Quito y sus competencias son a nivel nacional, esta organización se rige a partir a lineamientos y prácticas internacionales, los antes mencionados. [4]
La SAE otorga la acreditación, concordando con las normas de organismos internacionales, la competencia técnica de aquellas organizaciones que solicitan en materia de evaluación de conformidad, además se encarga de la coordinación de la suscripción de acuerdos de reconocimiento mutuo, supervisión de las entidades ya acreditadas y determinación de condiciones técnicas requeridas para el ofrecimiento de servicios a terceros. De la misma manera, tiene la función de promoción de la acreditación en todos los ámbitos científicos y tecnológicos, difundiendo las ventajas de la acreditación. [5]
La SAE [6] utiliza además la norma ISO 17025-2005 para la acreditación de laboratorios clínicos. La norma ISO 17025-2005 es una norma internacional creada por la Organización Internacional de Estandarización (ISO), en esta se establecen los requisitos necesarios que deben cumplir los laboratorios de ensayo y calibración, esta norma es utilizada por los laboratorios para probar su competencia técnica y su capacidad de otorgar resultados válidos [7].
En la actualidad el Ecuador cuenta con 1419 Centros de Salud que prestan servicios gratuitos a la comunidad, estos se encuentran distribuidos de la siguiente manera: 648 en el sector urbano y 771 en el sector rural, dentro de estos podemos encontrar 88 laboratorios clínicos que prestan sus servicios a los centros de salud los que se encuentran localizados entre Costa, Sierra y Oriente con el fin de brindar una atención de calidad y calidez a todos los usuarios y satisfaciendo la necesidad de los mismos. Todos estos centros se encuentran bajo la Rectoría, regulación, planificación, coordinación, control y gestión del Ministerio de Salud pública del Ecuador (MSP).
En el Ecuador existen tres laboratorios clínicos acreditados por la SAE:
· Laboratorio Clínico Pazmiño y Narváez de la ciudad de Quito, el campo acredito es química e inmunoquímica.
· Laboratorio Matlab S.A en la ciudad de Quito, el campo acreditado es hematología, química, inmunoquímica y coagulación.
· Laboratorio Centro Illingworth S.A en la ciudad de Guayaquil, su campo acreditado es hematología, química e inmunoquímica
El centro de Salud Enrique Ponce Luque brinda servicios de salud a pacientes, arrancando con sus actividades el 2 junio de 1989, siendo acreditado como centro de salud inclusivo el 6 diciembre del 2015. En sus inicios solo prestaba servicios de medicina general y fue el 3 de marzo del 2002 cuando se inició la construcción de un área destinada a laboratorio clínico debido a la gran afluencia de usuarios, de esta manera empezó a cumplir sus funciones el 2 de febrero del 2003 con un equipo laboral conformado por 4 empleados. Actualmente cuenta con 12 personas; 1 químico farmacéutico, 7 licenciados en laboratorio clínico, 3 auxiliares y 1 tecnólogo.
1.1 Calidad en laboratorios clínicos
La importancia de la calidad en el funcionamiento de los laboratorios de salud en los países en desarrollo ha sido universalmente reconocida. Los laboratorios que practican los principios de garantía de calidad generan resultados pertinentes, fiables y rentables. [8]
Calidad significa cumplir con las normas. Los estándares son requisitos para una sustancia o servicio en particular predeterminado. La calidad es de suma importancia en los laboratorios, los resultados confiables producidos por un laboratorio clínico ayudan a mejorar la capacidad de toma de decisiones de los médicos y esto a su vez influye en la salud pública. [9]
Las consecuencias de la mala calidad podrían ser graves; podría dar lugar a la acción o falta de acción apropiada en un tratamiento, o investigación, la falta de tratamiento o investigaciones inadecuadas generan respuestas tardías o subóptimas, como consecuencia de la mala calidad de los servicios de laboratorio podrían afectar negativamente a la credibilidad del laboratorio y también invitar a acciones legales. [10]
Un sistema de calidad bien definido que es una parte de la gestión global de una organización de salud está destinada a garantizar la coherencia, la reproducibilidad, la trazabilidad y la eficacia de los productos o servicios. En consecuencia, un sistema de calidad se define como la estructura organizativa y los recursos necesarios para implementar los requisitos de calidad [11].
La Organización Internacional de Normalización (ISO) define que un sistema de calidad está formado por organización de la estructura, responsabilidades, procedimientos, procesos y recursos para la implementación de la gestión de calidad [12]
Un sistema de calidad tiene los siguientes cinco elementos clave:
· Gestión y la estructura organizativa
· Documentación
· Monitoreo y Evaluación
· Formación
· Normas de calidad [13]
2. Materiales y métodos
Para obtener los datos de esta investigación, los autores realizan un diagnóstico del laboratorio clínico a través de la observación de las áreas relacionadas con la misma, la valoración se considera esencial para verificar la necesidad de implementación de una norma internacional, además de su propio análisis los autores realizan entrevistas a todos los trabajadores de este laboratorio para obtener su diagnóstico sobre los déficit del lugar, esta información es posteriormente procesada y analizada [14].
2.1 Instrumento de investigación
Lista de chequeo
Los autores observaron el funcionamiento del laboratorio clínico en varios días separados, para determinar las falencias de este en aspectos específicos incluidos en una lista de chequeo basada en la norma ISO 17025-2005. Esta lista se divide en los siguientes criterios;
Aspectos evaluados en la organización
· Sistema de Gestión
· Control de Documentos
· Revisión de los pedidos, ofertas y contratos. Subcontratación e ensayos y calibraciones.
· Compras de servicios y de suministros.
Estos requisitos fueron clasificados como; implementado, parcialmente implementado y no implementado según lo observado por los autores en el laboratorio Enrique Ponce Luque.
2.2 Entrevista
Se entrevistaron a todos los colaboradores del lugar para recolectar estos datos desde la percepción del trabajador, esta información fue procesada para obtener los datos relevantes y verificables
2.3 Diagrama de causa y efecto
Este fue el inicio de la investigación con un diagrama ISHIKAWA o causa y efecto donde se registran todos los datos una vez analizados.
2.4 Población y Muestra
El laboratorio clínico Enrique Ponce Luque tiene una población de 12 personas. Por ser una población pequeña, se selecciona a toda la población como muestra.
Tabla 1. Distribución del personal en el laboratorio
|
Distribución del personal del laboratorio clínico en el centro de salud "enrique Ponce Luque " |
||
|
Profesión |
Hombre |
Mujer |
|
Químico farmacéutico |
1 |
0 |
|
Laboratorista clínico |
3 |
4 |
|
Aux. Laboratorio |
0 |
2 |
|
Bachiller |
0 |
1 |
|
Tecnólogo en laboratorio |
0 |
1 |
2.5 Ventajas de la propuesta del diseño de gestión en base a la norma ISO 17025-2005
Con la propuesta del diseño de gestión de la norma ISO 17025-2005 en el laboratorio, podemos alcanzar ventajas que ayudan al cambio de muchos procesos que no se encuentran alineados ante los requerimientos establecidos por el MSP.
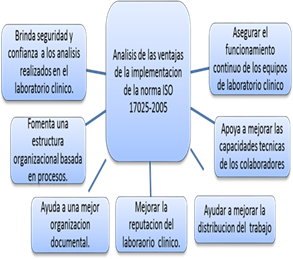
Fig. 1. Ventajas de la implementación de la norma ISO 17025
3. Resultados
Luego del análisis efectuado con la lista de verificación, se obtuvieron los siguientes resultados que constatan el estado actual en el que se encuentra el laboratorio Enrique Ponce Luque. Esta lista se divide en 2 criterios; organización y requisitos técnicos que a su vez se dividen.
Los criterios observados en la organización son; sistema de gestión, control de documentos, revisión de pedidos, ofertas y contratos, subcontratación de ensayos y calibraciones, compras de servicios y suministros, servicio al cliente, quejas, control de trabajos de ensayos o calibraciones no conformes, mejora, acciones correctivas, acciones preventivas, control de riesgos auditorías internas y revisión por la dirección. Los aspectos valorados en requisitos técnicos son; personal, instalaciones y condiciones ambientales, método de ensayo y de calibración y validación de métodos, equipos, trazabilidad de las mediciones, muestreo, manipulación del ítem de ensayo o de calibración, aseguramiento de la calidad de los resultados de ensayo y calibración e informe de resultados. Estos requisitos fueron clasificados como; implementado, parcialmente implementado y no implementado utilizando los métodos de observación y encuestas a los colaboradores.
Realizando una evaluación global de todos los requisitos que conforman la lista de verificación, se puede apreciar que la mayoría de los criterios no se encuentran implementados siendo estos el 80%, continuando con los requisitos parcialmente implementados se obtuvo un porcentaje de 14,29% y finalmente se encontró un 5,71% de requisitos implementados.
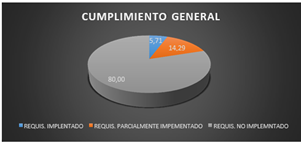
Fig. 2. Cumplimiento general
3.1 Resultado de requisitos:
3.1.1 Organización
En base a la comparación del apartado 4.1 y los procesos del laboratorio, se puede apreciar que solo el 30,77% de los requisitos son implementados en el laboratorio, el 23,08% son requisitos implementados parcialmente y por último el 46,15% de los requisitos no son implementados.
El cumplimiento de los requisitos que alcanza el 30,77%, se origina por:
· Las obligaciones legales del laboratorio, ya que estas se mantienen actualizados y en regla, tomando en cuenta que dicho laboratorio pertenece a un organismo público (MSP).
· La evidencia del organigrama, y la descripción de la persona encargada del laboratorio.
· La definición de los backup de todo el personal del laboratorio y la capacitación constante del mismo sobre el impacto que puede causar la mala práctica en el laboratorio.
Los requisitos implementados parcialmente son conformados por:
· Si fueron establecidas las responsabilidades claves del personal, pero estas no se encuentran documentadas y son comunicadas verbalmente.
· El laboratorio cuenta con un personal directivo y técnico, pero no todos poseen el perfil adecuado para realizar las actividades encomendadas.
· Cuenta con políticas para garantizar la protección de la información confidencial y los derechos de los clientes, la comunicación de las mismas la realizan de manera verbal, ya que no existen las políticas documentadas.
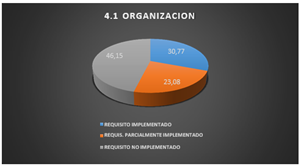
Fig. 3. Organización
3.1.2 Sistema de gestión
En este punto se puede apreciar que el laboratorio no ejecuta ninguno de estos requisitos.
Cumple parcialmente con 14,29%, ya que la dirección informa a sus colaboradores cuán importante es cumplir con los requisitos de los clientes, legales y reglamentarios, pero no evidencian registros de capacitación para cumplir con dichos requisitos.
Por último, los requisitos no implementados conforman un 85,71%.
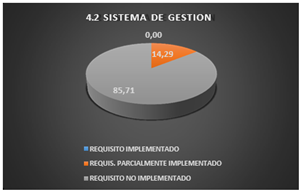
Fig. 4. Sistema de Gestión
3.1.3 Control de los documentos
En los requisitos relacionados a Control de los documentos se puede constatar que el laboratorio no cuenta con ningún requisito implementado.
Los requisitos parcialmente implementados abarcan el 14,29% ya que cuentan con documentos que son identificados con fecha de emisión, etc., sin embargo, dichos formatos se diligencian discontinuamente debido a que no siempre están disponibles por falta de recursos.
El 85,71% de los requisitos no son implementados por que los cambios de la documentación lo realizan el encargado del laboratorio bajo sus propios criterios, las modificaciones se realizan verbalmente y no existen definidos los procedimientos para asignar responsables de los documentos.
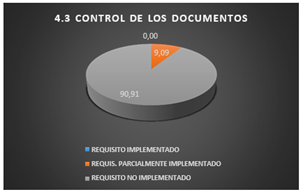
Fig. 5. Control documental
3.1.4 Revisión de los pedidos, ofertas y contrato
Con lo que respecta a la revisión de los pedidos, oferta y contrato se puede observar que el 100% de los requisitos de este apartado no se encuentran implementados.
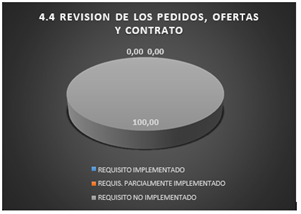
Fig. 6. Revisión de los pedidos y contrato
3.1.5 Subcontratación de ensayo y calibración
En este gráfico se puede apreciar que el 100% de los requisitos de este apartado no están implementados en el laboratorio.

Fig. 7. Subcontratación de ensayo y calibración
3.1.6 Compras de servicios y suministros
Los resultados en este apartado expresan que el laboratorio cumple con un 25% con respecto a los requisitos de compras de servicios y suministros; las requisiciones las realizan en presencia de insumos solicitados por laboratorio; una vez llegados los mismos, se realiza revisión de; lotes, código, descripción, nombre y fecha de vencimiento, adicionalmente revisan que todo reactivo que llegue al laboratorio debe de contar con el certificado de análisis.

Fig. 8. Compras de servicios y suministros
3.1.7 Servicio al cliente
Podemos observar que el laboratorio no cumple con ninguno de los requisitos correspondientes a servicio al cliente por ende el 100% a requisitos no se encuentra implementado.

Fig. 9. Servicio al cliente
3.1.8 Acciones correctivas
En los requisitos que comprenden a las acciones correctivas se puede constatar que el laboratorio no cuenta con ningún requisito implementado o parcialmente implementado, como observamos en la Gráfico 9.

Fig. 10. Acciones correctivas
3.1.9 Acciones preventivas
En el gráfico 10 podemos observar los requisitos con respecto a las acciones preventivas realizadas por el laboratorio, el porcentaje correspondiente a requisitos no implementados es del 100 %.

Fig. 11. Acciones preventivas
3.1.10 Control de riesgos
En el gráfico 11 correspondiente al apartado 4.13 de la norma ISO 17025-2005, se refleja que el 33.33 % de los requisitos son parcialmente implementados ya que:
· Los registros se almacenan después de ser generados o manipulados, pero todos están expuestos a futuros daños y deterioro porque estos documentos no se encuentran en un ambiente adecuado.
· Los registros son conservados en estanterías, pero estas no son sitios seguros que garanticen la conservación y la confidencialidad.
· La Gráfico 4.13 refleja el 66.67% la cual es originado por las siguientes causas:
· El laboratorio no cuenta con procedimientos para proteger y salvaguardar los registros almacenados electrónicamente y prevenir el acceso no autorizado.
· Cuando existe un error en algún registro vuelven a repetirlo ya que para ellos es primordial mantener los registros legibles pero el dato al que se le hace la corrección lo eliminan.
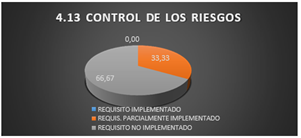
Fig. 12. Control de riesgo
3.1.11 Auditoría Interna
En la Gráfico 12 podemos observar la ausencia de requisitos implementados relacionados a auditorías internas, el 100 % no se encuentran implementados

Fig. 13. Revisión por la dirección
3.1.12 Personal
En el apartado 5.2 que hace referencia al personal se puede visualizar que la mayoría de los apartados cumplen parcialmente, ocupando el 80% del pastel, todo esto acontece:
· Ya que los colaboradores que operan los equipos cuentan con experiencias, pero la dirección no realiza evaluaciones para asegurarse que los operarios puedan manejar con facilidad ciertos equipos.
· Existen los perfiles de cargos creados para el laboratorio, pero aun así hay personas sin la formación adecuada que ocupan puestos que no van acorde al perfil requerido.
· El personal encargado del laboratorio es dirigido y controlado por un supervisor, pero no existen indicadores que midan la competencia de él.
· Se evidencia que el laboratorio cuenta con perfiles de cargo, pero la última vez sé que actualizaron fue en el año 2013.

Fig. 14. Personal
3.1.13 Instalaciones y condiciones ambientales
Siendo este un laboratorio que tiene que tener presente las condiciones e instalaciones dispuestas para realizar sus actividades, se logra identificar que de todos los requisitos del apartado 5.3 de la norma 17025-2005 refleja cumplimiento parcial siendo un 20%, ya que el laboratorio cuenta con condiciones ambientales en la que se puede realizar las actividades tales como: iluminación y espacio, pero existen huecos que no ayudan a la privacidad del mismo, corriendo el riesgo de que se origine la contaminación cruzada de muestras en procesos.
El 80% de los requisitos sobre las instalaciones y condiciones ambientales no son implementados.
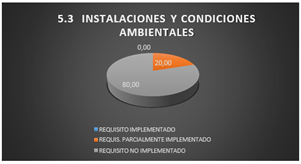
Fig. 15. Instalaciones y condiciones ambientales
3.1.14 Métodos de ensayo y calibración y de validación de los métodos
En el laboratorio se realizan métodos de ensayo, pero no se cuenta con los equipos necesarios para la manipulación y la realización de los ensayos.
En estos criterios correspondiente al método de calibración y ensayo y validación de métodos cumplen parcialmente el 66.67% y los criterios que no se cumplen van enfocado al 33.33%.

Fig. 16. Ensayo, calibración y validación de métodos
3.1.15 Equipos
En el laboratorio se evidencia que los equipos se encuentran identificados con el respectivo nombre del equipo y código de este, por cumplir con ese requisito del apartado 5,5, se refleja que en el pastel ocupa el 8,33%.
Los requisitos parcialmente implementados se observan en el grafico 5.5 que ocupan el En el laboratorio se evidencia que los equipos se encuentran identificados con el respectivo nombre del equipo y código del mismo, por cumplir con ese requisito del apartado 5,5, se refleja que en el pastel ocupa el 8,33%. ya que los equipos cuentan con la hoja de autorización en la cual mencionan las personas autorizadas a utilizarlos, pero no incluyen las instrucciones del manejo de equipos.
Los requisitos que no son implementados conforman el 83,33% ya que los equipos son sometidos a una sobrecarga, porque no son registrados como fuera de servicio, sino que siguen siendo utilizados sin importar que el tiempo de vida útil haya caducado.
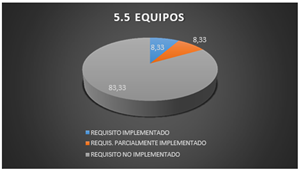
Fig. 17. Equipos
3.1.16 Trazabilidad de mediciones
En el apartado sobre trazabilidad de mediciones, el 100 % de los requisitos no se encuentran implementados.
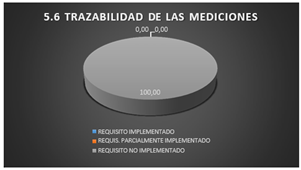
Fig. 18. Trazabilidad de las mediciones
3.1.17 Muestreos
El laboratorio no cuenta con un plan y procedimientos para muestreos y registros de datos, por ende, los requisitos no implementados abarcan el 100% del grafico 5.7.
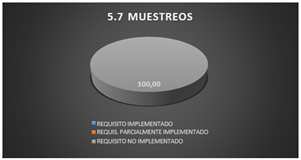
Fig. 19. Muestreos
3.1.18 Manipulación de los ítems de ensayo o de calibración
En la Gráfico 19 podemos observar que no se encuentra implementado ningún requisito.

Fig. 20. Manipulación de los ítems de ensayo o de calibración
3.1.19 Aseguramiento de la calidad de los resultados de ensayo y de calibración
El 100 % de los requisitos de este apartado no se encuentran implementados.

Fig. 21. Aseguramiento de la calidad de los resultados de ensayos y calibración
3.1.20 Informe de resultados
Los informes de resultados que realiza el laboratorio no están de acuerdo con las directrices requeridas por este apartado, en el que se refleja que el 100% de los requisitos no son implementados.

Fig. 22. Informes de resultado
4. Conclusiones
En base al trabajo desarrollado en el laboratorio clínico Enrique Ponce Luque se concluyó que:
Estas son algunas de las características requeridas por la norma ISO 17025-2005, como pudimos observar el cumplimiento general fue bajo, esto nos permite concluir que en cuanto a calibración y trazabilidad el laboratorio clínico Enrique Ponce Luque no posee los requerimientos mínimos para el funcionamiento del mismo acorde a las normas internacionales.
A pesar de que en nuestro estudio la norma no fue implementada, se observa una diferencia notoria y podemos esperar grandes beneficios para la institución y la comunidad a la que sirve.
Los requisitos implementados abarcan el 5.71 % y conforman las responsabilidades del personal clave, pero estas son comunicadas de una forma verbal, es decir, no son documentadas, se cuenta con personal directivo y técnico suficiente, sin embargo, no todo el personal tiene el perfil adecuado para realizar estas actividades. En esta institución cuenta con políticas para asegurar la protección de la información confidencial y los derechos de los clientes, pero solo de manera verbal, no se evidenció que hayan sido documentadas.
En los requisitos relacionados al sistema de gestión; la dirección comunica a los trabajadores de forma verbal la importancia de cumplir con los requisitos de los clientes, legales y reglamentarios, pero no se evidencian registros en la cual los colaboradores hayan sido capacitados para cumplir con dichos requisitos.
El 14,29 % pertenece a los requisitos implementados parcialmente, obteniendo el resultado en base a la gestión de documentos, los documentos son identificados con fecha de emisión y numeración de las páginas, sin embargo, cuando no existen recursos, se dejan de generar dichos formatos. La mayor parte de los requisitos no son implementados resaltando el 80%, ya que los cambios de la documentación lo realizan el encargado del laboratorio bajo su propio criterio, y las modificaciones se realizan verbalmente y no se definen procedimientos para dejar una persona autorizada a realizar los cambios de estos. La revisión de los insumos se realiza quincenalmente; se observan los lotes, el código, fecha de vencimiento, todo reactivo debe llegar con un certificado de análisis.
El laboratorio clínico no cuenta con las condiciones ambientales correctas para la realización de los procesos que se llevan a cabo en el mismo, puede generarse contaminación cruzada. Los métodos de ensayo y calibración no son planificados en el laboratorio, ya que no se cuentan los recursos necesarios.
Referencias-
|
[1] |
flacsoandes.edu.ec, junio 2008. [En línea]. Available: https://flacsoandes.edu.ec/web/imagesFTP/1217229872.nra_carrion_draftwp_es1.pdf. |
|
[2] |
«OMS,» 2021. [En línea]. Available: https://www.unaids.org/es/aboutunaids/unaidscosponsors/who. |
|
[3] |
«Organización Mundial de la Salud,» 19 diciembre 2019. [En línea]. Available: https://www.who.int/es/news-room/questions-and-answers/item/what-are-the-international-health-regulations-and-emergency-committees#:~:text=%C2%BFQu%C3%A9%20son%20el%20Reglamento%20Sanitario%20Internacional%20y%20los%20Comit%C3%A9s%20de%20Emergencias%3F,-1. |
|
[4] |
«tecniprecisión,» 2021. [En línea]. Available: https://www.tecniprecision.com/ec/acreditacion/. |
|
[5] |
«Servicio de Acreditación Ecuatoriano,» 2019. [En línea]. Available: https://www.acreditacion.gob.ec/derechos-y-obligaciones-sae/. |
|
[6] |
GOV.CO, «SAE,» 25 05 2018. [En línea]. Available: https://www.saesas.gov.co/nuestra_entidad/quienes_somos. |
|
[7] |
F. J. Duque-Aldaz, H. A. Pérez Benítez, J. P. Fierro Aguilar y E. G. Pazán Gómez, Las 7 Herramientas básicas de la calidad, Guayaquil: CIDEPRO, 2019. |
|
[8] |
ICSA, «Requisitos generales para la competencia de los laboratorios de ensayo y calibración,» [En línea]. Available: https://www.icsa.es/laboratorios-analiticos/consultoria-de-laboratorios/norma-iso-17025. |
|
[9] |
«Sanatorio Sagrado Corazón,» 14 agosto 2020. [En línea]. Available: http://www.sagradocorazon.mx/importancia-del-sistema-de-gestion-de-calidad-en-los-laboratorios-de-prueba/. |
|
[10] |
«Ifcc.org,» 2019. [En línea]. Available: https://www.ifcc.org/media/214854/Errores%20en%20el%20laboratorio%20cl%C3%ADnico.pdf. |
|
[11] |
T. L. Carpio Figueroa, L. D. Beltrán Mestanza, F. J. Duque-Aldaz, H. A. Pérez Benítez, J. P. Fierro Aguilar y G. W. Tobar Farías, «Desarrollo de un Balanced Scorecard aplicado a una Universidad en el área de Gestión Social del Conocimiento,» Espacio, vol. 40, nº 15, p. 9, 2019. |
|
[12] |
«Euroinnova,» 2020. [En línea]. Available: https://www.euroinnova.ec/blog/que-es-un-sistema-de-calidad. |
|
[13] |
INEN, «REQUISITOS GENERALES PARA LA COMPETENCIA DE LOS LABORATORIOS DE ENSAYO Y CALIBRACIÓN,» 2018. [En línea]. Available: https://www.normalizacion.gob.ec/buzon/normas/nte_inen_iso_iec_17025.pdf. |
|
[14] |
A. Rodríguez Gómez, M. A. Suriaga Sánchez, G. E. Medina Pinoargote, R. J. Calderón Angulo y F. J. Duque_Aldaz, La eficiencia y la eficacia en procesos administrativos, Guayaquil: CIDEPRO, 2019. |