1. Introducción
Los polímeros fueron en su día materiales ideales, pero con el tiempo causaron daños al medio ambiente [1]. Esto llevó a buscar alternativas ecológicas con una funcionalidad similar [2]. Recientemente, la celulosa bacteriana se ha estudiado en diversas ciencias [3]. En medicina ayuda en el tratamiento de quemaduras y en ingeniería alimentaria sustituye a los recubrimientos sintéticos [4]. Aunque muchas bacterias producen biopolímeros [5], Acetobacter Xylinum se considera la mejor para la producción de celulosa debido a su comportamiento simbiótico con otros microbios, prosperando en cualquier medio de cultivo [6].
Esta investigación pretende sustituir el té negro por té elaborado a partir de cáscaras de café en la producción de bebidas de Kombucha. El objetivo es lograr una producción adecuada de celulosa y abaratar los costes del medio de cultivo para las bacterias, añadir valor a los residuos del café y beneficiar al medio ambiente. En las últimas décadas, la producción de celulosa ha sido un proceso empírico centrado en generar polímeros estructurales a partir de plantas para satisfacer una demanda exponencialmente creciente [2]. El consiguiente efecto invernadero, la contaminación, la reducción de oxígeno y la escasez de recursos llevaron a buscar un polímero alternativo. Aunque las aplicaciones de los polímeros de celulosa no pueden reducirse, la investigación empezó a orientarse hacia la búsqueda de otras fuentes disponibles de forma natural. La reutilización de subproductos del café en la producción de celulosa puede ser una solución sostenible y respetuosa con el medio ambiente [7].
La fabricación de plásticos, los elevados costes y la limitada disponibilidad de celulosa sintética también resultaron problemáticos para las industrias debido al uso de productos químicos y a la degradación estructural. Para hacer frente a estos problemas, se inició la búsqueda de un material nuevo y más eficaz, libre de productos químicos y contaminantes que pudieran dañar el medio ambiente [8]. En 1953, los doctores Hestrin y Schramm investigaron la obtención de celulosa a partir de la bacteria Acetobacter Xylinum. Su trabajo se basaba en estudios anteriores que demostraban que estas bacterias podían sintetizar celulosa a partir de células no proliferativas en entornos oxigenados utilizando un sustrato de carbono. Hestrin y Schramm desarrollaron un medio de cultivo ideal, definiendo la glucosa como la fuente de carbono básica para el crecimiento microbiano. También recomendaron nutrientes como el extracto de levadura y compuestos de pH bajo, apodando al medio "HS" [9].
Investigaciones posteriores aumentaron el rendimiento de la celulosa optimizando las proporciones de sustrato y nutrientes [10]. Los doctores Hassid y Barker propusieron utilizar sacarosa por ser químicamente más estable que la glucosa, aunque manteniendo los demás nutrientes. Zhou [11] varió las proporciones de glucosa y sacarosa junto con licor de maíz y compuestos sulfatados como nutrientes. Zhou [12] también propuso utilizar bajas concentraciones de etanol manteniendo su medio. Los estudios de Cakar, [13] Gomes [14] y Pacheco [15] sustituyeron la fuente básica de carbono por residuos agrícolas para potenciar la celulosa sin nutrientes externos [16]. La cáscara de café puede sustituir al té negro, aportando alcaloides funcionales como la cafeína y la teobromina como residuo barato. Illana [17] descubrió que el té negro Kombucha era un medio de cultivo ideal, ya que el té proporciona sustratos óptimos y alcaloides como la teína que ayudan al desarrollo de la membrana celulósica durante la incubación.
La celulosa bacteriana es un polímero extracelular sintetizado por fermentación de microorganismos, principalmente la bacteria Acetobacter. Este microbio fue descubierto por primera vez en 1886 por Adrian J. Brown como "una membrana gelatinosa translúcida que crece en la superficie del medio de cultivo". Sin embargo, otras bacterias como Rhizobium, Agrobacterium y Sarcina también pueden producir celulosas [18]. Las teorías de por qué los microbios producen biopolímeros incluyen: los aerobios generan una membrana para permanecer en la interfaz aire-medio, los microbios fabrican celulosa para evitar los rayos UV y las bacterias forman un "armazón" para protegerse de amenazas externas como los metales pesados al tiempo que asimilan mejor los nutrientes por difusión [19]. La celulosa bacteriana es químicamente similar a la celulosa vegetal, pero presenta importantes diferencias estructurales [20]. Una distinción clave es la mayor pureza de la celulosa microbiana, que carece de hemicelulosa y lignina asociadas [14]. La celulosa bacteriana forma cristales de celulosa Iα e Iβ [21].
El cafeto es un arbusto frondoso del género Coffea, de la familia de las Rubiáceas. Prospera en climas tropicales y subtropicales ecuatoriales. Su composición es un fruto carnoso en forma de cereza que contiene altos porcentajes de alcaloides [22]. Las cáscaras que rodean la semilla, llamadas pergamino, y el mucílago tienen un alto contenido en azúcares y bajo en metilxantinas en comparación con la cereza. La pulpa es la porción más grande y determina las variedades por su estructura química [23].
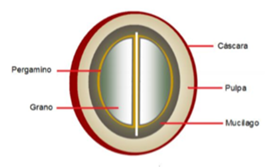
Fig. 1. Parte de un grano de café
Fuente: [24]
1.3. Nutrientes de la cáscara de café
Dentro de los beneficios y propiedades que tiene la infusión de cáscara de café, presentan un contenido bajo de cafeína, una capacidad antioxidante relacionada con los flavonoides, una concentración total de compuestos fenólicos similar a la de otro té. Presenta una elevada actividad prebiótica y antioxidante, incluso mayor a la de la vitamina c [25].
La cascarilla del café representa aproximadamente el 12 % del grano de café en base seca, está constituida como una excelente fuente de celulosa, lignina, pentosanos, sílice, cenizas y otros compuestos en menor proporción [26].
Dentro de la composición física y química de la cáscara de café según Fonseca [27] se encuentra:
Tabla 1. Composición física y química de la cáscara de café
|
(%) |
(%) |
(%) |
(%) |
(%) |
(%) |
||
Fuente: Fonseca [27]
1.4. Composición del café género Coffea Arábica
Como ya se ha mencionado anteriormente, la variedad Caturra proveniente del género Bourbon conserva la mayoría de sus características químicas de su predecesor, Coffea Arábica [28]. Por otra parte, en el tostado de café se originan más de cien compuestos volátiles que aportan al aroma y sabor durante las infusiones, tales como: ácido acético, ácido cafeico, acetaldehídos, cetonas, compuestos provenientes del furfural, furanos y ésteres que en su mayoría desaparecen debido a las altas temperaturas, a los cuales se someten normalmente los granos de café [29]. Por otra parte, las bebidas del café alcanzan un pH óptimo que oscila entre los 4.9 y 5.2 haciéndolas ligeramente acidas.
La siguiente tabla muestra la información nutricional del café arábica como infusión:
Valor nutricional por cada 100 g de infusión de café.
Tabla 2. Composición química del Coffea Arábica
|
Nutriente |
Valor Unidades |
|
Carbohidratos |
0 |
|
Grasas |
0,02 g |
|
Proteínas |
0,12 g |
|
Agua |
99,40 g |
|
Cafeína |
40 mg |
|
Tiamina (vit. B1) |
0,014 mg |
|
Riboflavina (vit. B2) |
0,076 mg |
|
Niacina (vit. B3) |
0,191 mg |
|
Ácido pantoténico (vit. B5) |
0,254 mg |
|
Vitamina B6 |
0,001 mg |
|
Vitamina E |
0,01 mg |
|
Calcio |
2 mg |
|
Magnesio |
3 mg |
|
Manganeso |
0.023 mg |
|
Fósforo |
3 mg |
|
Potasio |
49 mg |
|
Zinc |
0,02 mg |
Fuente: Tomado de USDA, 2018
Aunque la mayoría de estos componentes se concentran en la pulpa, la cascarilla aporta con un porcentaje de 14,76 % de furfural y lo restante lo complementa la lignina con un 41,86 % además de grasas y pentosas en la misma. Además, se puede encontrar concentraciones de nitrógeno y fósforo de 0,39 % y 28 mg respectivamente [30].
Por cada 100 g de cereza de café en fresco se tiene la siguiente composición [23], donde el 6 % corresponde a la cáscara.
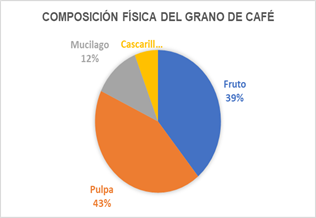
Fig. 2. Composición física del grano de café
Fuente: (Merchán & Tigre, 2019)
1.5. Producción a nivel nacional
A continuación, se presentan las superficies cafetaleras en el Ecuador distribuidas por los géneros Coffea Arábica y Coffea Robusta. Además, cabe destacar que el género Caturra comprende más del 90 % de las variedades existentes en el país [31].
Tabla 3. Producción de Coffea Arábica y Coffea Robusta en Ecuador
|
Provincias |
Coffea arábica (ha) |
Coffea robusta (ha) |
|
Manabí |
70.050 |
0 |
|
Santa Elena |
1.800 |
0 |
|
Guayas |
11.195 |
425 |
|
Los Ríos |
4.770 |
6.610 |
|
El Oro |
9.730 |
0 |
|
Carchi |
195 |
0 |
|
Imbabura |
300 |
0 |
|
Pichincha |
1.300 |
1.300 |
|
Santo Domingo |
0 |
5.300 |
|
Cotopaxi |
2.000 |
1.600 |
|
Tungurahua |
0 |
0 |
|
Bolívar |
3.410 |
3.780 |
|
Chimborazo |
880 |
0 |
|
Cañar |
370 |
0 |
|
Azuay |
420 |
0 |
|
Loja |
29.345 |
0 |
|
Sucumbíos |
0 |
17.320 |
|
Orellana |
0 |
20.000 |
|
Napo |
120 |
4.800 |
|
Pastaza |
150 |
0 |
|
Morona Santiago |
290 |
120 |
|
Zamora Chinchipe |
6.350 |
0 |
|
Galápagos |
1.100 |
0 |
Fuente: Aguilar [32]
En el 2016 los cultivos del género Coffea Arábica descendieron en comparación al año 2015, teniendo 3.905 toneladas. Sin embargo, la producción de café en el año 2017 incrementó en un 12 % debido al ingreso de cafetales nuevos con el “Proyecto de Reactivación de la Caficultura Ecuatoriana”, donde la variedad de este producto antes nombrada fue ingresada a provincias cuyas condiciones climáticas eran óptimas para su desarrollo, destacándose Loja y Manabí. En datos históricos, el Ecuador era quinto productor y exportador a nivel mundial de café hasta el año 2015; sin embargo, en la actualidad se ubica en el puesto 28 [33].
2. Materiales y métodos
La sustitución del té se evaluó mediante experimentos. En primer lugar, se sustituyó el té negro por té de cáscara de café al 25 %, 50 %, 75 % y 100 %, utilizando 200 g de sacarosa según Aguilar y Espín (2019). En el segundo experimento se modificó la concentración de sacarosa y se agregó el medio HB control (0,25% extracto de levadura, 0,25 % sulfato de calcio, 0,5 % fosfato de potasio, 0,83 % sulfato de amonio, 0,2 % sulfato de magnesio) para un óptimo crecimiento bacteriano sin alterar la estructura celular. Las constantes para ambos experimentos fueron 15 días de incubación, 25 ± 3 °C de temperatura, pH inicial de 3,5 y cantidad de inóculo. Los recipientes eran idénticos en forma, volumen y material para cada tratamiento. El primer experimento tuvo 5 tratamientos con 3 repeticiones cada uno en 5 cultivos. El segundo tenía 5 tratamientos con 3 repeticiones en 2 cultivos.
Tabla 4. Condiciones de experimento 1. 20 % azúcar
|
Identificaciones E1 |
Sustitución de infusión de té (%) |
||||
|
Denominación del tratamiento |
T1 |
T2 |
T3 |
T4 |
T5 |
|
Concentración de té negro (%) |
100 |
75 |
50 |
25 |
0 |
|
Concentración de infusión de cáscaras de café (%) |
0 |
25 |
50 |
75 |
100 |
Fuente: (Merchán & Tigre, 2019)
Los reactivos usados para el control del segundo experimento fueron grado reactivo y su formulación se efectuó según el contenido del medio HB.
Tabla 5. Condiciones del experimento 2. 10 % azúcar
|
Identificaciones E2 |
Sustitución de infusión de té (%) |
|||||
|
Denominación del tratamiento |
Control (HB) |
T1 |
T2 |
T3 |
T4 |
T5 |
|
Concentración de té negro (%) |
0 |
100 |
75 |
50 |
25 |
0 |
|
Concentración de infusión de cáscaras de café (%) |
0 |
0 |
25 |
50 |
75 |
100 |
|
Concentración del medio HB |
100 |
0 |
0 |
0 |
0 |
0 |
Fuente: (Merchán & Tigre, 2019)
2.1. Análisis de materia prima
Las materias primas café y té fueron evaluadas en su contenido de humedad según la norma NTE INEN 1114 y cenizas a través de gravimetría mediante la norma TAPPI T 211 para celulosa en la prueba de ceniza. Se realizó por 3 repeticiones.
2.2. Análisis de producto terminado
Como producto terminado se considera al líquido fermentado y a la membrana de celulosa. El líquido fue evaluado en el contenido de: pH y sólidos solubles. Mientras que la celulosa fue evaluada en: peso en base húmeda, peso en base seca, rendimientos diarios y quincenales, humedad, cenizas, espesor, tensión, permeabilidad, absorción, determinación de porcentaje de celulosa, caracterización de espectros FTIR, microscopía de electrónica de barrido (MEB).
2.3. Rendimientos diarios y quincenales.
Para el cálculo de rendimiento quincenal, se tomó el peso en gramos de la membrana de celulosa seca y se lo dividió por la cantidad de sustrato añadido en un litro. Dicho sustrato varió en peso de acuerdo con el experimento 1 y experimento 2.
Se usó la siguiente fórmula.
|
|
(1) |
El rendimiento diario del medio de cultivo se calculó a través de dividir el resultado de la Ec. 1 para el número de días de siembra (15 d).
|
|
(2) |
Se realizó a través del método gravimétrico por diferencia de peso, según la norma NTE INEN 1114 [34]. Consistió en secar un recipiente con su tapa durante 1 hora en la estufa a la temperatura de secado del producto. Empleando pinzas, se trasladó la cápsula tapada al desecador y se dejó enfriar durante 5 a 10 minutos. Se pesó el recipiente con tapa (m1). Se colocó la muestra en el recipiente de aluminio y se registró (m2). La muestra con el recipiente destapado y tapa se colocaron en la estufa a 105°C durante 4 horas. Luego de este tiempo, la muestra tapada se retiró de la estufa y enfrió en un desecador durante 5 a 10 minutos. Se repitió el procedimiento de secado hasta que las variaciones entre dos pesadas sucesivas sean constantes. Se registra (m3). La determinación se realizó por triplicado.
La humedad del producto se expresó en porcentaje con la Ec 3:
|
|
(3) |
Donde:
H = Humedad
![]() =
peso del recipiente vacío con tapa.
=
peso del recipiente vacío con tapa.
![]() =
masa del recipiente tapado con la muestra antes del secado.
=
masa del recipiente tapado con la muestra antes del secado.
![]() = masa
del recipiente con tapa más la muestra después del secado.
= masa
del recipiente con tapa más la muestra después del secado.
Se utilizó el procedimiento de la norma TAPPI T 211 para celulosa en la prueba de ceniza [35]. Por ello, se tomó un gramo de muestra seca de las películas en un crisol previamente pesado, se medió su peso inicial y se procedió a calcinar en una mufla a 525 °C. El crisol con la muestra de cenizas se dejó enfriar en un desecador para luego apuntar su peso final.
El porcentaje de ceniza se calculó mediante la Ec 4:
|
|
(4) |
Donde:
![]() =masa
del crisol
=masa
del crisol
![]() =masa
de cenizas (final)
=masa
de cenizas (final)
![]() =masa
de muestra (inicial)
=masa
de muestra (inicial)
2.6. Capacidad de absorción de agua
El ensayo fue realizado según el método descrito por Joaquín [36]. Láminas de celulosa de 2 cm x 2cm fueron evaluadas durante 30 min, a fin de determinar cuánta agua absorben. Para ello, se registró el peso de cada lámina de celulosa (M1) con ayuda de balanza analítica. En un vaso de precipitación con 50 ml de agua destilada se colocó la lámina y en agitación constante se mantuvieron durante 3 horas. Con pinza se retiró la lámina a un vidrio de reloj. Se registró el nuevo peso (M2). Se analizaron por triplicado.
|
|
(5) |
En donde:
M2 = Peso de muestra húmeda.
M1 = Peso inicial de la muestra seca.
3. Resultados
3.1. Identificación morfológica de la bacteria Acetobacter xylinum.
De acuerdo con la ilustración 5 y 6, se observa varias colonias de bacilos alargados con diversas estructuras. En ambas imágenes se puede apreciar una coloración violeta – fucsia, lo cual nos permite inferir que dichas bacterias son Gram negativas pertenecientes al género “Acetobacter”, cuyas agrupaciones están dadas por medio de cadenas largas y de forma ovoide.
En la ilustración 5, se realizó un acercamiento 10 X usando el microscopio óptico con una baja intensidad de luz. La ilustración 6 Presenta un acercamiento 40 x, en donde se puede apreciar de mejor manera la morfología estructurada del género bacteriano.
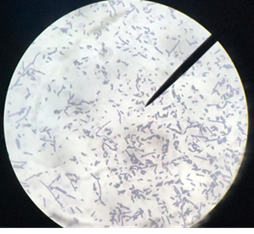
Fig. 3. Presenta un acercamiento 40x, en donde se puede apreciar de mejor manera la morfología estructurada del género bacteriano
Fuente: (Merchán & Tigre, 2019)

Fig. 4. Microscopía óptica de la bacteria Acetobacter xylinum en aumento de 10x.
Fuente: (Merchán & Tigre, 2019)
3.2. Resultados de materia prima
Los resultados de humedad y cenizas están presentados en la tabla 6, se observa que los valores de cenizas de la cáscara de café son similares a los obtenidos por Manals (2017). El valor de humedad presenta una materia prima seca libre de posibilidad de contaminación por crecimiento de hongos.
Tabla 6. Resultado de humedad y cenizas del té negro y la cáscara de café
|
Humedad (%) y cenizas (%) de la materia prima |
||||||||
|
*CC1 |
CC2 |
CC3 |
X±S |
**TN1 |
TN2 |
TN3 |
Promedio |
|
|
% Humedad |
10.08 a ± 0.13 |
10,07 a± 0.06 |
10.39 a± 0.61 |
10,075 ± 0,007 |
6,14 a± 0.04 |
6,13 a± 0.04 |
6,12 a± 0.024 |
6,13 ± 0,009 |
|
% Cenizas |
1,37 a± 0.467 |
1,71 b± 0.418 |
2,04 c± 0.1621 |
1,706 ± 0,335 |
4,56 a± 0.15 |
4,67 a± 0.03 |
4.70 a± 0.04 |
4,685± 0,067 |
* CC representa a cascara de café, ** TN representa a té negro
* Letras iguales indican que no existe diferencia significativa entre ellas a un nivel de significancia del 0,05.
Fuente: (Merchán & Tigre, 2019)
3.3. Análisis de producto terminado
Se obtuvieron dos productos como resultado de la fermentación de la Kombucha, uno es el líquido fermentado y otro es la membrana de celulosa.
La figura 5 muestra la variación de los resultados en referencia al pH y sólidos solubles del jarabe fermentado de Kombucha. El valor del pH entre los tratamientos del experimento 1 es constante, al igual que los valores del pH del experimento 2. El valor menor de pH es igual a 2,20 ± 0,50, mismo que corresponde al control del experimento 2, mientras que el valor mayor de pH es de 3,25 ± 0,27 y corresponde al tratamiento T3 del E1. De acuerdo con Lestari [10], los valores de un pH óptimo para el crecimiento de bacterias productora de celulosa se encuentran entre 2.0-3.0, indicando que, en estas condiciones, los microorganismos se desarrollan de mejor manera.
De acuerdo a la figura 5, el valor de sólidos solubles del T1 es mayor que los valores de T2, T3, T4 y T5 del experimento 1; mientras que los valores de los tratamientos del Experimento 2 no son significativamente diferentes. El valor de los sólidos solubles (SS) del T1 E1 es mayor que el de los otros tratamientos del E1, el cual no contiene la infusión de la cáscara de café. Por tanto, mientras mayor sea el valor de sólidos disueltos significa, mayor presencia de sacarosa y menor consumo por parte de los microorganismos y con ello menor producción de celulosa. Es decir, la fuente de carbono o sacarosa es asimilada de mejor forma en los tratamientos donde existe la presencia de la cáscara de café.
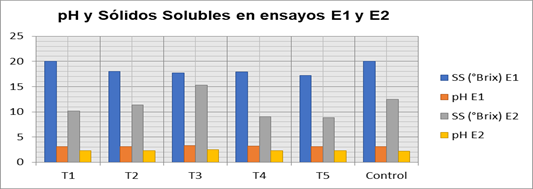
Fig. 5. pH y sólidos solubles (SS) de E1 y E2
Fuente: (Merchán & Tigre, 2019)
En ésta se observa que el T5 de ambos experimentos, que contiene una infusión solamente de cáscara de café, exhibe el mayor contenido de cenizas de 7,56 % mientras que el valor menor de cenizas de 3,23 % corresponde al T1 solo infusión de té negro, existiendo diferencia significativa entre estos tratamientos. Este resultado permite inferir que una mayor concentración de café produce membranas de celulosa con más altos contenidos de minerales y componentes inorgánicos.
Tabla 7. Composición de las membranas de celulosa: humedad, cenizas y espesor de membranas secas
|
Tratamientos |
||||||
|
Experimentos (E) |
Parámetros |
T1 |
T2 |
T3 |
T4 |
T5 |
|
1 |
Humedad (%) |
17,21a ± 0,87 |
10,38b ± 0,21 |
10,41b ± 0,76 |
18,11a ± 2,33 |
10,14b ± 0,68
|
|
Cenizas (%) |
3,23a ± 1,49 |
5,72ab ± 2,31 |
6,34ab ±1,95 |
4,81ab ±0,84 |
7,56b ± 0,57 |
|
|
Espesor (mm) |
0,16 a ± 0,02 |
0,26b ± 0,01 |
0,26b ± 0,001 |
0,73c ± 0,04 |
0,38d ± 0,02 |
|
|
2 |
Humedad (%) |
12,614a± 0,47 |
17,65b ± 0,189 |
14,044b ± 0,306 |
17,02a ± 0,284 |
18,648b ± 0,289 |
|
Cenizas (%) |
3,098a ± 0,75 |
5,992ab ± 0,75 |
4,616ab ± 1,30 |
4,214ab ± 0,635 |
7,56b ± 0,883 |
|
|
Espesor (mm) |
0,694a ± 0,15 |
0,766b ± 0,29 |
0,533b ± 0,076 |
0,733c ± 0,12 |
0,493d ± 0,15 |
|
*Letras iguales determina que no existe diferencia significativa entre ellas
Fuente: (Merchán & Tigre, 2019)
El espesor de cada membrana le permite comportarse de una manera específica, siendo menos flexible mientras el espesor es mayor. El T4 presenta una estructura más firme y sólida en donde se puede inferir que hubo un mayor grado de polimerización por parte de la celulosa.
La figura 6 muestra las redes de humedad, cenizas y espesor de las membranas terminadas tanto del E1 como de E2, en cada tratamiento. El contenido de humedad en el E1 de los tratamientos T1 y T4 no varía de manera significativa entre sí, sin embargo, es significativamente diferente a los valores de los tratamientos T2, T3 y T5. Las membranas fueron sometidas al mismo tratamiento de secado, sin embargo; el valor mayor de humedad de la membrana del T4 con 18,11 % indica que debe ser secada adicionalmente ya que de lo contrario sería vulnerable para el crecimiento de levaduras y hongos

Fig. 6. Humedad, cenizas y espesor de membranas
Fuente: (Merchán & Tigre, 2019)
Tabla 8. Resultado de producción de celulosa del experimento 1
|
Producción de celulosa cultivo de 200 gramos |
|||||
|
|
T1 |
T2 |
T3 |
T4 |
T5 |
|
RDMS (%) |
0,19a ± 0,01 |
0,20a ±0,01 |
0,25ca ±0,01 |
0,53b ±0,003 |
0,29c ±0,003 |
|
RDMH (%) |
4,78a ±0,13 |
5,01a ±0,13 |
7,12ac ±0,10 |
9,93b ±0,17 |
7,87c ±0,55 |
|
RQMS (%) |
2,88a ±0,61 |
2,98a ± 1,43 |
3,67ac ±0,73 |
8b ±1,22 |
4,31c ±0,38 |
|
RQMH (%) |
71,67a ±1,89 |
75,17a ±1,89 |
106,83ac ±1,44 |
149,00b ±2,60 |
118,00c ±8,26 |
|
PMS (g) |
5,75a ±0,41 |
5,95a ±0,40 |
7,33ac ±0,34 |
15,99b ±0,11 |
8,62c ±0,09 |
|
PMH (g) |
143,33a ±3,79 |
150,33a ±3,79 |
213,67ac ±2,89 |
298,00b ±5,20 |
236,00c± 16,52 |
*Letras iguales indican que no existe diferencia significativa entre ellas a un nivel de significancia del 0,05.
Fuente: (Merchán & Tigre, 2019)
La tabla 8 muestra los valores de producción de celulosa, ya sea en forma de rendimiento diario, quincenal, peso en húmedo o en seco del E1. Esta tabla indica que la producción de celulosa del T1, T2 y T3 no difieren entre ellos, mientras que con respecto a los tratamientos T4 y T5 si existe diferencia significativa entre estos tratamientos.
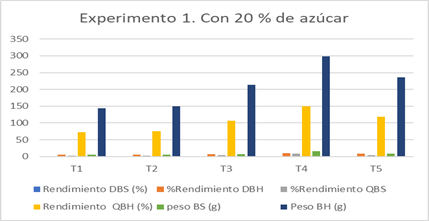
Fig. 7. Experimento 1 utilizando 200 gramos de azúcar
Fuente: (Merchán & Tigre, 2019)
El tratamiento 4 exhibe los mayores resultados de producción de celulosa, mientras que el resultado del tratamiento 3 es similar al del tratamiento 5.
La producción de T1 y T2 son similares y a pesar de que T2 y T3 no presenten diferencias significativas, se observa el incremento de la producción quincenal y diaria debido a la inclusión de mayor contenido de infusión de café. El efecto positivo de la infusión de cáscaras de café en la kombucha se empieza a analizar desde la sustitución del 50%, sin embargo, se observa que al sustituirse al 100 % el valor resultante de celulosa disminuye, por lo cual conviene mantener un porcentaje entre 50 a 75 % de infusión de té negro para obtener mejores resultados. El valor medio de rendimiento de T4 es superior al valor de 6 % de rendimiento presentado según Zhou [11], mientras que las demás pruebas superan al 3 % de rendimiento obtenido por Joseph [37].
A pesar de que el análisis estadístico general fue realizado por un (ANOVA) de dos vías, el análisis del porcentaje de celulosa comprende un (ANOVA) de solo un factor, el cual es el porcentaje de celulosa por cada tratamiento realizado. A través del Test de Tukey se conoce que en el tercer cultivo del experimento 1, el porcentaje de celulosa de los tratamientos T1 (62,83 ±0,31), T3 y T5 expresan que T1 es significativamente diferente de T3 y T5 (Ilustración 7). Sin embargo, entre T3 y T5 no existe deferencia significativa, lo cual permite inferir que con respecto a T4 no habría diferencia significativa en este parámetro, ya que su valor estará comprendido entre ambos tratamientos. Los valores altos de pureza de celulosa en los tratamientos con la inclusión del té de cáscara de café indica el efecto favorable de la adición con respecto al que no tiene.

Fig. 8. Porcentaje de Celulosa
Fuente: (Merchán & Tigre, 2019)
Se podría indicar además que a medida que se incluye una mayor proporción de cascara de café en el medio de cultivo como infusión, las membranas de celulosa presentan una mejor pureza.
La capacidad de absorción de agua fue independiente del contenido de infusión de té o de cáscaras de café, sin embargo; el valor de las películas de T4 y T2 son similares, por lo que se afirma que estas membranas tienen una mayor capacidad para receptar y contener fluidos externos como el agua. Este valor es recíproco al peso de las membranas húmedas del tratamiento 4, indicado en la tabla. De acuerdo con Costa [38] un biopolímero tiene una capacidad de absorción de agua del 80 a 85 %, valores similares a los obtenidos en esta investigación.
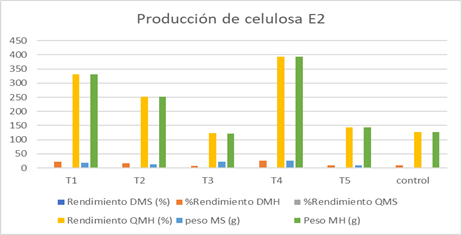
Fig. 9. Producción de celulosa. Experimento 2
Fuente: (Merchán & Tigre, 2019)
La producción de celulosa en E2 o con 10 % de azúcar varía con respecto a E1. De acuerdo con el análisis de varianza de dos factores que se indica en la tabla 9, existe diferencia significativa entre E1 y E2 en el rendimiento a un nivel de confianza del 95%.
Tabla 9. Anova de dos factores. Rendimiento quincenal
|
Variable dependiente: Rendimiento Quincenal |
|||||
|
Origen |
Tipo III de suma de cuadrados |
gl |
Cuadrático promedio |
F |
Sig. |
|
Modelo corregido |
1998,452 a |
10 |
199,845 |
675,090 |
0,000 |
|
Interceptación |
2594,795 |
1 |
2594,795 |
8765,390 |
0,000 |
|
Experimento |
1210,847 |
1 |
1210,847 |
4090,323 |
0,000 |
|
Tratamiento |
943,764 |
5 |
188,753 |
637,619 |
0,000 |
|
Experimento * Tratamiento |
198,718 |
4 |
49,679 |
167,821 |
0,000 |
|
Error |
6,513 |
22 |
0,296 |
|
|
|
Total |
5271,993 |
33 |
|
|
|
|
Total corregido |
2004,964 |
32 |
|
|
|
|
a. R al cuadrado = 0,997 (R al cuadrado ajustada = 0,995) |
|||||
Fuente: (Merchán & Tigre, 2019)
Al realizar un ANOVA en el experimento (E2), con relación a producción de celulosa, se observa que existe diferencia significativa entre los diversos tratamientos.
A través del ANOVA de dos factores se observó que en la producción de celulosa existe diferencia significativa entre los experimentos E1 y E2 a un nivel de confianza del 95 %.
Tabla 10. Evaluación comparativa de peso y rendimientos del E1 y E2
|
Evaluación comparativa de peso y rendimiento del E1 y E2 |
|||||
|
|
E1 y E2 |
N |
Media |
Desviación estándar |
Media de error estándar |
|
Peso |
Con 200 azúcar E2 |
3 |
15,9939 |
0,06355 |
0,03669 |
|
con 100 azúcar E1 |
3 |
25,0330 |
0,87413 |
0,50468 |
|
|
RQMH |
Con 200 azúcar E2 |
3 |
7,9970 |
0,03176 |
0,01834 |
|
con 100 azúcar E1 |
3 |
25,0330 |
0,87413 |
0,50468 |
|
Fuente: (Merchán & Tigre, 2019)
De acuerdo con la tabla 10, los valores máximos de peso y rendimiento corresponden al tratamiento T4 experimento 2 y a través de la prueba T se verifica que existe una diferencia significativa frente al tratamiento T4 del experimento 1. A través de esto se rechaza la hipótesis nula planteada y se acepta la alternativa, en el sentido de que si existe diferencia significativa en el rendimiento de producción de celulosa al incluir la infusión de cáscaras de café.
De acuerdo a la tabla 11, el valor de F de la prueba de Levene indica que el valor p (probabilidad) es menor del valor de la significancia 0,05 por lo que se rechaza la hipótesis de varianzas iguales y se analiza según varianzas desiguales. Al ser el valor de p obtenido menor que 0,05 se rechaza la igualdad de la hipótesis o igualdad de tratamientos en los experimentos E1 y E2.
|
Prueba de muestras independientes |
||||||||||
|
|
Prueba de Levene de Calidad de Varianzas |
Prueba t para la igualdad de medias
|
||||||||
|
|
F |
Sig. |
T |
Gl
|
Sig. (bilateral) |
Diferencia de medias |
Diferencia de error estándar |
95% de intervalo de confianza de la diferencia |
||
|
Inferior |
Superior |
|||||||||
|
Peso |
Se asumen varianzas iguales |
13,397 |
,022 |
-17,863 |
4 |
,000 |
-9,03913 |
,50601 |
-10,44405 |
-7,63422 |
|
No se asumen varianzas iguales |
|
|
-17,863 |
2,021 |
,003 |
-9,03913 |
,50601 |
-11,19465 |
-6,88362 |
|
|
RQMH |
Se asumen varianzas iguales |
14,522 |
,019 |
-33,734 |
4 |
,000 |
-17,03603 |
,50501 |
-18,43817 |
-15,63389 |
|
No se asumen varianzas iguales |
|
|
-33,734 |
2,005 |
,001 |
-17,03603 |
,50501 |
-19,20345 |
-14,86861 |
|
Fuente: (Merchán & Tigre, 2019)
La caracterización FTIR de las muestras de celulosa demostró espectros típicos de una celulosa vegetal.
Si
se traza una perpendicular en el número de onda correspondiente a 1500 ![]() , se
obtiene dos regiones en el plano de espectros infrarrojos correspondientes a la
zona de diagnóstico en el lado izquierdo, y la zona de huella dactilar en el
lado derecho.
, se
obtiene dos regiones en el plano de espectros infrarrojos correspondientes a la
zona de diagnóstico en el lado izquierdo, y la zona de huella dactilar en el
lado derecho.
Dentro
de la espectroscopía FTIR, la banda de onda que caracteriza a una celulosa está
comprendida entre los 3335 y 3290 ![]()
![]() [39]
[39]![]() .
En todos los tratamientos analizados se observan picos comprendidos en esos
valores, lo cual muestra que todas las membranas tienen una estructura igual a
la celulosa vegetal pero libre de lignina. Además, existen picos comprendidos
entre 1000 - 1100
.
En todos los tratamientos analizados se observan picos comprendidos en esos
valores, lo cual muestra que todas las membranas tienen una estructura igual a
la celulosa vegetal pero libre de lignina. Además, existen picos comprendidos
entre 1000 - 1100 ![]() , lo
cual demuestra la presencia de enlaces C-O-C, y cuyos compuestos forman las
moléculas beta glucosa que dan lugar a la celulosa [40].
, lo
cual demuestra la presencia de enlaces C-O-C, y cuyos compuestos forman las
moléculas beta glucosa que dan lugar a la celulosa [40].
Además,
todas las películas de celulosa presentan espectros en una longitud de banda de
1630 ![]() , lo
que es muy característico en celulosas con un alto porcentaje de humedad,
contenidas en la pulpa del papel [39].
, lo
que es muy característico en celulosas con un alto porcentaje de humedad,
contenidas en la pulpa del papel [39].
De
acuerdo con Rosma [41], la estructura de la celulosa bacteriana a base de
Kombucha comprende bandas desde 891.59 - 1424.18 ![]() comparándola
con una micro celulosa comercial y corroborando los picos obtenidos en todas
las muestras.
comparándola
con una micro celulosa comercial y corroborando los picos obtenidos en todas
las muestras.
La zona de huella dactilar permite diferenciar la estructura de cada membrana, en donde los tratamientos 4 y 5 son los únicos resultados que muestran espectros comprendidos entre 1227, 1159 y 1028 cm-1, y cuyas vibraciones pertenecen a los enlaces C-O-C, C-OH y β-glucopiranosa de celulosa. Sin embargo, este hecho no se cumple en los demás tratamientos, lo cual permite afirmar que las altas concentraciones de la infusión de cáscara de café en la composición de la celulosa, aumenta la cristalinidad y dureza de las membranas [42].
Analizando
nuevamente la zona de diagnóstico se puede observar que no existe ningún pico
entre las bandas de absorción de 1740 – 1850 ![]() ,
descartando la presencia de anhídridos de ácidos y cloruros de acilo y cuyas
vibraciones están comprendidas en dichas longitudes de bandas [40].
Por otra parte, el número de onda promedio correspondiente a las cetonas y
ácidos carboxílicos es 1715
,
descartando la presencia de anhídridos de ácidos y cloruros de acilo y cuyas
vibraciones están comprendidas en dichas longitudes de bandas [40].
Por otra parte, el número de onda promedio correspondiente a las cetonas y
ácidos carboxílicos es 1715 ![]() , por
lo cual se descarta de igual forma su presencia dentro de las muestras al no
existir ningún pico que corrobore su composición [41].
, por
lo cual se descarta de igual forma su presencia dentro de las muestras al no
existir ningún pico que corrobore su composición [41].
La ausencia de estos compuestos demuestra que se llevó a cabo un buen tratamiento de las membranas al realizar el lavado con hidróxido de sodio al 0,1 N y agua destilada a 80 °C, principio por el cual fue eliminar la presencia de dichos componentes orgánicos [43].
4. Conclusiones
De
acuerdo con el análisis de resultados, la sustitución de té negro por la
infusión de cáscara de café influye positivamente en la producción de celulosa
bacteriana. El T4 (75 % cáscara de café y 25 % té negro) mostró los mejores
rendimientos de producción, con un polímero de mejores características
mecánicas que los otros tratamientos, en donde la resistencia a la tracción de
dicho tratamiento fue 85 N `por un alargamiento de 45 mm., presentó un espesor
de 0,788 mm, y los espectros infrarrojos variaron desde 3400 a 1750 ![]() lo
cual es propio de una membrana de celulosa. Sin embargo, a pesar de que el
análisis de ceniza fue 4 % y su humedad 17 %, la sustitución con la infusión de
cáscaras de café fue más efectiva aún con el experimento 2 que permitió la
obtención del rendimiento más alto (25 %) y de mayor pureza (87 %) de todos los
tratamientos.
lo
cual es propio de una membrana de celulosa. Sin embargo, a pesar de que el
análisis de ceniza fue 4 % y su humedad 17 %, la sustitución con la infusión de
cáscaras de café fue más efectiva aún con el experimento 2 que permitió la
obtención del rendimiento más alto (25 %) y de mayor pureza (87 %) de todos los
tratamientos.
Por otra parte, la ausencia total de éste afecta en el rendimiento de producción de celulosa. Esto fue demostrado en el tratamiento 5 (100 % Cáscara de café), cuyo valor promedio fue el 11 %.
La variación del consumo de sustrato expresado en grados Brix y el nivel de acidez dado en pH por cada experimento presenta diferencia significativa, sin embargo, sus valores se mantienen constantes entre tratamientos. Los valores del pH fluctúan entre los 2 – 2.5, volviendo al medio de cultivo óptimo para el desarrollo del género Acetobacter.
Los costos de producción para desarrollar la membrana de celulosa están por debajo de los 9 $ por película incluyendo el IVA actual. De acuerdo con Nava [44], el costo de una membrana fluctúa los 11 $ considerando el elevado costo del inóculo de Kombucha y los sustratos del medio de cultivo. El precio bajo de la cáscara de café proporciona una disminución proporcional al valor agregado en la obtención de la celulosa.
El uso de la cáscara de café en la producción de celulosa bacteriana permitirá darle un valor agregado a este subproducto y adicionalmente disminuir los costos de producción del polímero.
Referencias
|
[1] |
V. H. Guerrero, «Nuevos materiales:aplicaciones estructurales e industriales,» pp. 33-46, 2011. |
|
[2] |
F. Billmeyer, Ciencia de los polímeros, Reverte, 2015. |
|
[3] |
A. Batista-Cruzado, «Efecto en la regeneración ósea guiada de una membrana de PLGA modificada a nivel microtopográfico con plasma de oxígeno y funcionalizada con una capa inorgánica de óxido de silicio,» Universidad de Sevilla. Departamento de Estomatología, pp. 27-30, 2015. |
|
[4] |
L. A. Caicedo, «Técnicas de fermentación y aplicaciones de celulosa bacteriana,» Ingeniería y Ciencia, pp. 315-318, 2012. |
|
[5] |
L. Miranda, «PROPIEDADES ANTAGÓNICAS DE KOMBUCHA A , FITOPATOGENOS FUNGOSOS EN CONDICIONES "IN VITRO",» UNIVERSIDAD NACIONAL DE CAJAMARCA , pp. 22 - 27, 2014. |
|
[6] |
F. Malamud, «Bases moleculares del desarrollo de biofilms en Xanthomonas axonopodis pv citri y su rol en el proceso infectivo,» Universidad de Buenos Aires, pp. 13-15, 2011. |
|
[7] |
C. Saizar, «Línea de base para evaluar el impacto de una planta de celulosa en el Río Uruguay,» INNOTEC, 2010. |
|
[8] |
N. Orellana, «Reutilización de polímetros como alternativa socio ambiental y económica en la elaboración de eco bloques,» Cuenca, 2015. |
|
[9] |
Hestrin, «Synthesis of Cellulose by Acetobacter xylinum,» Hebrew University, pp. 346-350, 1954. |
|
[10] |
P. Lestari, «Study on the Production of Bacterial Cellulose from Acetobacter Xylinum,» Jordan Journal of Biological Sciences , pp. 75-80, 2013. |
|
[11] |
L. Zhou, «Effect of addition of sodium alginate on bacterial cellulose production by Acetobacter xylinum,» Society for Industrial Microbiology, pp. 484 - 487, 2007. |
|
[12] |
H. J. Son, «Optimization of fermentation conditions for the production of bacterial cellulose by a newly isolated Acetobacter sp. A9,» Miryang National University, pp. 1-4, 2001. |
|
[13] |
F. Cakar, «Improvement production of bacterial cellulose by semi-continuous process in molasses medium,» Carbohydrate Polymers, pp. 7-12, 2014. |
|
[14] |
F. Gomes, «Production of bacterial cellulose by Gluconacetobacter sacchari,» Biomass&Bioenergy, pp. 1-6, 2012. |
|
[15] |
G. Pacheco, «Development and characterization of bacterial cellulose produced by cashew tree residues as alternative carbon source,» Industrial Crops & Products, pp. 14-18, 2017. |
|
[16] |
M. U. Rani, «Production of bacterial cellulose by Gluconacetobacter hansenii UAC09 using coffee cherry husk,» Association of Food Scientists & Technologists, pp. 755-760, 2011. |
|
[17] |
C. Illana, «El Hongo Kombucha,» Boletín de la socieda micológica de Madrid, pp. 269 -272, 2007. |
|
[18] |
T. Higuchi, «Bioquímica de la lignina: Biosíntesis y biodegradación.,» Springer link, p. https://link.springer.com/article/10.1007/BF00225306, 1990. |
|
[19] |
González, «OPTIMITZACIÓN DE LA BIOSÍNTESIS DE NANOCELULOSA BACTERIANA POR FERMENTACIÓN,» Cataluña, 2017. |
|
[20] |
A. Adnan, «GLYCEROL AS A CHEAPER CARBON SOURCE IN BACTERIAL CELLULOSE PRODUCTION BY GLUCONACETOBACTER XYLINUS,» MALAYSIAN JOURNAL OF ANALYTICAL SCIENCES, pp. 1132-1135, 2015. |
|
[21] |
González, «Optimización de la biosíntesis de nanocelulosa bacteriana por fermentación.,» UNIVERSITAT POLITECNICA DE CATALUNYA, p. https://upcommons.upc.edu/bitstream/handle/2117/115472/TFM.pdf?sequence=1&isAllowed=y, 2017. |
|
[22] |
M. Alulima, «Alternativas agroecológicas para el manejo del café (coffea arabica),» Universidad de Cuenca, pp. 19-20, 2012. |
|
[23] |
J. Arcila, «Sistema de Produccion de café,» Cenicafé, pp. 49-50, 2010. |
|
[24] |
E. Manals, «Caracterización de la biomasa vegetal “cascarilla de café”,» Universidad De oriente Santiagao de Cuba, p. 171, 2017. |
|
[25] |
A. Gómez, «Transformación termoquímica de la biomasa residual del proceso de extracción del aceite de palma: tecnologías y perspectivas,» Revista Palma, p. 390, 2004. |
|
[26] |
R. Rathinavelu, «Posibles usos alternativos de los residuos y subproductos del café,» Organización mundial del café, p. 2, 2005. |
|
[27] |
F. Fonseca, «Biomass briquetting and its perspectives in Brazil,» Elsevier, p. 239, 2011. |
|
[28] |
B. Carriel, «Detección y Caracterización de Bacterias Endofíticas en Árboles de Cafeto (Coffea arabica L.) y de Sombra en Puerto Rico,» ProQuest Dissertations , pp. 1-2, 2012. |
|
[29] |
Y. Balcàzar, «EXTRACCIÓN DEL AROMA DE CAFÉ, POR ARRASTRE DE VAPOR UTILIZANDO DESTILACIÓN,» Universidad de Guayaquil, pp. 4-6, 2011. |
|
[30] |
E. R. Jiménez, «Café I (G. Coffea),» Universidad Complutense de Madrid, pp. 116-117, 2014. |
|
[31] |
A. d. l. H. Gutiérrez, «CARACTERIZACIÓN DE GENES DE POLIGALACTURONASAS DE Fusarium oxysporum f.sp. Y SU ANÁLISIS EN SISTEMAS,» UNIVERSIDAD COMPLUTENSE DE MADRID, pp. 22-23, 2008. |
|
[32] |
E. Aguilar, «Café Arabica Coffea arabica,» Springer, pp. 39-62, 2018. |
|
[33] |
L. D. Carreño, «Efecto de las Condiciones de Cultivo y Purificación,» Universidad Nacional de Colombia, pp. 18-29, 2011. |
|
[34] |
N. t. Ecuatoriana, «Café soluble. Determinación de pérdida por calentamiento,» NTE INEN 1114, 2010. |
|
[35] |
TAPPI, «Ash in wood, pulp, paper and paperboard: combustion at 525°C,» T 211 om-02 , 2002. |
|
[36] |
D. F. JoaquiI, «PROPIEDADES ÓPTICAS Y PERMEABILIDAD DE VAPOR DE AGUA EN PELÍCULAS,» Biotecnología en el Sector Agropecuario y Agroindustrial, p. 63, 2014. |
|
[37] |
G. Joseph, «Effects of polyacrylamide-co-acrylic acid on cellulose production by Acetobacter xylinum,» Journal of Chemical Technology and Biotechnology, pp. 964-969, 2003. |
|
[38] |
S. Costa, «Sugarcane Straw and Its Cellulose Fraction as Raw Materials for Obtainment of Textile fibers and Other Bioproducts,» Springer, 2015. |
|
[39] |
H. Contreras, «ESPECTROSCOPIA ATR-FTIR DE CELULOSA: ASPECTO INSTRUMENTAL Y TRATAMIENTO MATEMÁTICO DE ESPECTROS,» e-Gnosis, 2010. |
|
[40] |
P. Mondragón, «ESPECTROSCOPIA DE INFRARROJO PARA TODOS,» Unidad de Tecnología Alimentaria, Jalisco, 2017. |
|
[41] |
A. Rosma, «Microstructure and physical properties of microbial cellulose produced during fermentation of black tea broth,» Penang, 2012. |
|
[42] |
J. Zara, «mpleo de la Espectroscopia Infrarroja (FT-IR-ATR) como herramienta para la Caracterización del bagazo de caña proveniente de la Sierra Falconiana,» QuímicaViva , 2017. |
|
[43] |
M. J. B. M. M. Soriano, «“SÍNTESIS Y ESTUDIO DE PROPIEDADES DE CELULOSA BACTERIANA OBTENIDA DE PIÑA Y BANANO, INOCULADOS CON KOMBUCHA,» Repositorio Universidad de Guayaquil, pp. http://repositorio.ug.edu.ec/bitstream/redug/27913/1/Tesis-Celulosa-Bacteriana-Pi%C3%B1a-Banano.pdf, 2018. |
|
[44] |
M. Nava, «Diseño de planta piloto para producción de Celulosa Bacteriana,» Barcelona, 2016. |